Nežiaduce účinky mRNA vakcín proti C-19: "spike" hypotéza
https://doi.org/10.1016/j.molmed.2022.04.007, 20. apríla 2022
Najdôležitejšie informácie
mRNA vakcíny proti koronavírusovej chorobe 2019 (COVID-19) vyvolávajú robustné imunitné odpovede proti koronavírusu 2 s ťažkým akútnym respiračným syndrómom (SARS-CoV-2), avšak ich bunkový/molekulárny spôsob účinku a etiológia vyvolaných nežiaducich účinkov (AE) zostávajú stále neobjasnené.
Lipidové nanočastice (LNP) majú pravdepodobne širokú distribúciu v ľudských tkanivách/orgánoch; môžu tiež (spolu so zabalenou mRNA) pôsobiť prozápalovo.
Vakcíny s mRNA proti COVIDu-19 kódujú transmembránový hrotový (S) proteín SARS-CoV-2; môže však dochádzať k vylučovaniu antigénu a/alebo súvisiacich peptidových fragmentov do obehu.
Väzba cirkulujúceho proteínu S na angiotenzín konvertujúci enzým 2 (ACE2) (ktorý je rozhodujúci pre rovnováhu systému renín-angiotenzín) alebo na iné ciele spolu s možnosťou molekulárnej mimikry s ľudskými proteínmi môže prispieť k AE súvisiacim s očkovaním.
Profil prínosu a rizika je naďalej priaznivý pre očkovanie proti COVIDu-19, avšak prospektívna farmakovigilancia a dlhodobé monitorovanie očkovaných príjemcov by mali byť prioritou v oblasti verejného zdravia.
Očkovanie je hlavným nástrojom na zmiernenie pandémie koronavírusového ochorenia 2019 (COVID-19) a mRNA vakcíny sú ústredným prvkom prebiehajúcej očkovacej kampane, ktorá nepochybne zachraňuje tisíce životov. Boli však zaznamenané nežiaduce účinky (AE) po očkovaní, ktoré môžu súvisieť s prozápalovým pôsobením použitých lipidových nanočastíc alebo dodanej mRNA (t.j. zloženia vakcíny), ako aj s jedinečnou povahou, spôsobom expresie, väzbovým profilom a prozápalovými účinkami vyrobených antigénov – spike proteínu (S) a/alebo jeho podjednotiek/peptidových fragmentov – v ľudských tkanivách alebo orgánoch. Súčasné poznatky o tejto téme pochádzajú väčšinou z bunkových testov alebo z modelových organizmov; ďalší výskum bunkového/molekulárneho základu AE vyvolaných mRNA vakcínou bude preto prísľubom bezpečnosti, zachovania dôvery a usmerňovania zdravotnej politiky.
Boj proti pandémii COVIDu-19 pomocou mRNA vakcín proti SARS-CoV-2 kódujúcich S proteín
COVID-19 spôsobuje koronavírus ťažkého akútneho respiračného syndrómu 2 (SARS-CoV-2) (box 1) a má za následok milióny úmrtí na celom svete. Napriek tomu u väčšiny osôb infikovaných vírusom SARS-CoV-2 zostane COVID-19 bez príznakov alebo len s miernymi príznakmi [1.,2.]. Hoci SARS-CoV-2 môže cirkulovať aj v gastrointestinálnom trakte [3.], keďže ide o respiračný vírus, samotný vírus ani jeho príbuzné antigény vo väčšine prípadov neovplyvnia iné tkanivá a orgány ako dýchací systém (RS) (box 1) [4., 5., 6.]. U pacientov so závažným ochorením môže infekcia dýchacích ciest a pľúcnych tkanív spôsobiť zápal pľúc a nadmerný zápal, ktorý môže viesť k syndrómu akútnej respiračnej tiesne (ARDS) (pozri Slovník na konci článku) (box 1) [7., 8., 9., 10.]. ARDS potom môže viesť k poškodeniu orgánov mimo RS z dôvodu mikro- alebo makrotromboembólie, hyperzápalu, aberantnej aktivácie komplementu alebo rozšírenej virémie [7., 8., 9., 10., 11., 12., 13.]. Môže to byť spôsobené širokou expresiou jeho receptora angiotenzín konvertujúceho enzýmu 2 (ACE2) vo viacerých typoch buniek a tkanív [14., 15., 16.], čo má za následok rozšírenie tropizmu SARS-CoV-2 pre rôzne kritické orgány (srdce, pankreas, obličky atď.). Ak sa zabráni systémovému kolapsu a smrti, postulovaný priamy "útok" vírusu – alebo nepriame účinky v dôsledku cytokínovej búrky [10.,13.] alebo nerovnováhy systému renín-angiotenzín (RAS) [13.] – spôsobujúci multiorgánové poškodenie, prípadne podporí systémové defekty, ktoré spôsobia chronický stav (označovaný ako dlhý COVID-19), ktorý je nezávisle spojený so závažnosťou počiatočného ochorenia [17.].
BOX 1
Infekcia ľudských buniek vírusom SARS-CoV-2
Infekcia ľudských buniek vírusom SARS-CoV-2 prebieha prostredníctvom jeho väzby na bunkový povrchový proteín ACE2 cez RBD jeho vyčnievajúceho S glykoproteínu [127.], ktorý zostáva v metastabilnom prefúznom stave prostredníctvom asociácie podjednotiek 1 (S1) a 2 (S2) prostredníctvom nekovalentných interakcií [18.,19.]; proces infekcie uľahčujú aj proteázy hostiteľa [127.,128.]. U väčšiny nosičov infikovaných vírusom SARS-CoV-2 sa vírus nachádza v hornej časti RS, čo vedie buď k žiadnym príznakom, alebo k miernym príznakom [1.,2.]. Menšia časť si vyžiada hospitalizáciu; je to v dôsledku závažných príznakov, ktoré sa vyvinú v dôsledku rozsiahleho zápalu, procesu často označovaného ako "cytokínová búrka", spôsobujúceho ARDS, ktorý môže byť sprevádzaný virémiou a môže viesť k systémovému multiorgánovému kolapsu [7., 8., 9., 10.]. Riziko závažného COVIDu-19 sa výrazne zvyšuje s vekom alebo už existujúcimi komorbiditami [1.,2.,129.] a mladší jedinci majú podstatne nižšie riziko – dokonca aj v porovnaní s chrípkovou infekciou [129.] – vzniku závažného COVIDu-19 [130.,131.]. Predpokladá sa, že vyššia vrodená interferónová odpoveď u detí obmedzuje replikáciu vírusu a progresiu ochorenia [132.]. V nedávnej štúdii, v ktorej boli mladí ľudia úmyselne vystavení nízkej dávke SARS-CoV-2, sa takmer polovica účastníkov nenakazila, niektorí boli asymptomatickí a tí, u ktorých sa vyvinul COVID-19, uvádzali mierne až stredne závažné príznaky vrátane bolesti hrdla, nádchy, kýchania a straty čuchu a chuti; horúčka bola menej častá a u nikoho sa nevyvinul pretrvávajúci kašeľ [133.].
Infekcia SARS-CoV-2 u zdravých jedincov vyvoláva vrodené aj adaptívne reakcie imunitného systému, t.j. T-bunky CD4+ a CD8+ a protilátky vrátane neutralizujúcich protilátok (NAbs) produkovaných terminálne diferencovanými B-bunkami, ktoré celkovo potláčajú rozsah infekcie [132.,134.,135.]. Keďže SARS-CoV-2 spočiatku infikuje horné RS, obranné imunitné reakcie sa začínajú vyvíjať na povrchu slizníc dýchacích ciest a po nich nasleduje systémová imunita [136.,137.]. Tieto imunitné reakcie sú závislé od veku a pohlavia a môžu sa buď slabo rozvinúť na pozadí genetických príčin a už existujúcich ochorení, alebo sa stanú veľmi intenzívnymi a v podstate nekontrolovateľnými pri ťažkom ochorení, ktoré vedie k ARDS a systémovému zlyhaniu [11., 12., 13.].
Po bezprecedentnom úsilí biomedicínskeho výskumu a mobilizácii zdrojov dve mRNA vakcíny – konkrétne BNT162b2 (ComirnatyTM) od spoločnosti Pfizer-BioNTech a mRNA-1273 spoločnosti Moderna (kódovaný antigén: SARS-CoV-2 S proteín kmeňa Wuhan-Hu-1) [18., 19., 20.] – ako prvé získali povolenie FDA na núdzové použitie. Pri mRNA vakcínach, ktoré sa vyznačujú relatívne rýchlou tvorbou prototypov a výrobou vo veľkom meradle, sa mRNA kódujúca proteín S dodáva prostredníctvom lipidových nanočastíc (LNP) do ľudských buniek, ktoré produkujú zrelý vírusový proteín alebo príbuzné antigény (obr. 1, kľúčový obrázok), ktoré môžu vykazovať pomerne širokú tkanivovú/orgánovú distribúciu (o ktorej sa hovorí neskôr) [20., 21., 22.]. Okrem pravdepodobnej prozápalovej úlohy LNP (o ktorej svedčia aj hlásené bezprostredné alergické reakcie) [23.,24.] a zabalenej mRNA – ktorá však bola upravená nahradením uridínu pseudouridínom [20.,25.,26.]. ] tak, aby nevyvolával vrodenú imunitu prostredníctvom receptorov molekulárnych vzorov spojených s patogénmi (PAMPs) alebo molekulárnych vzorov spojených s poškodením (DAMPs) – predpokladáme, že nežiaduce účinky (AE) sprostredkované očkovaním možno pripísať jedinečným vlastnostiam samotného proteínu S (antigénu) buď v dôsledku molekulárnej mimikry s ľudskými proteínmi, alebo ako ligandu ACE2.
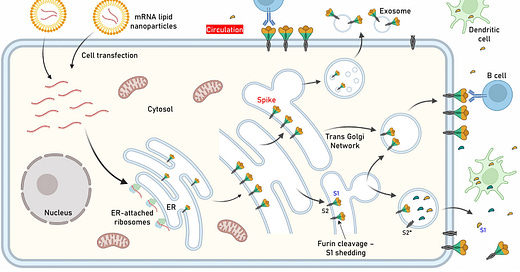
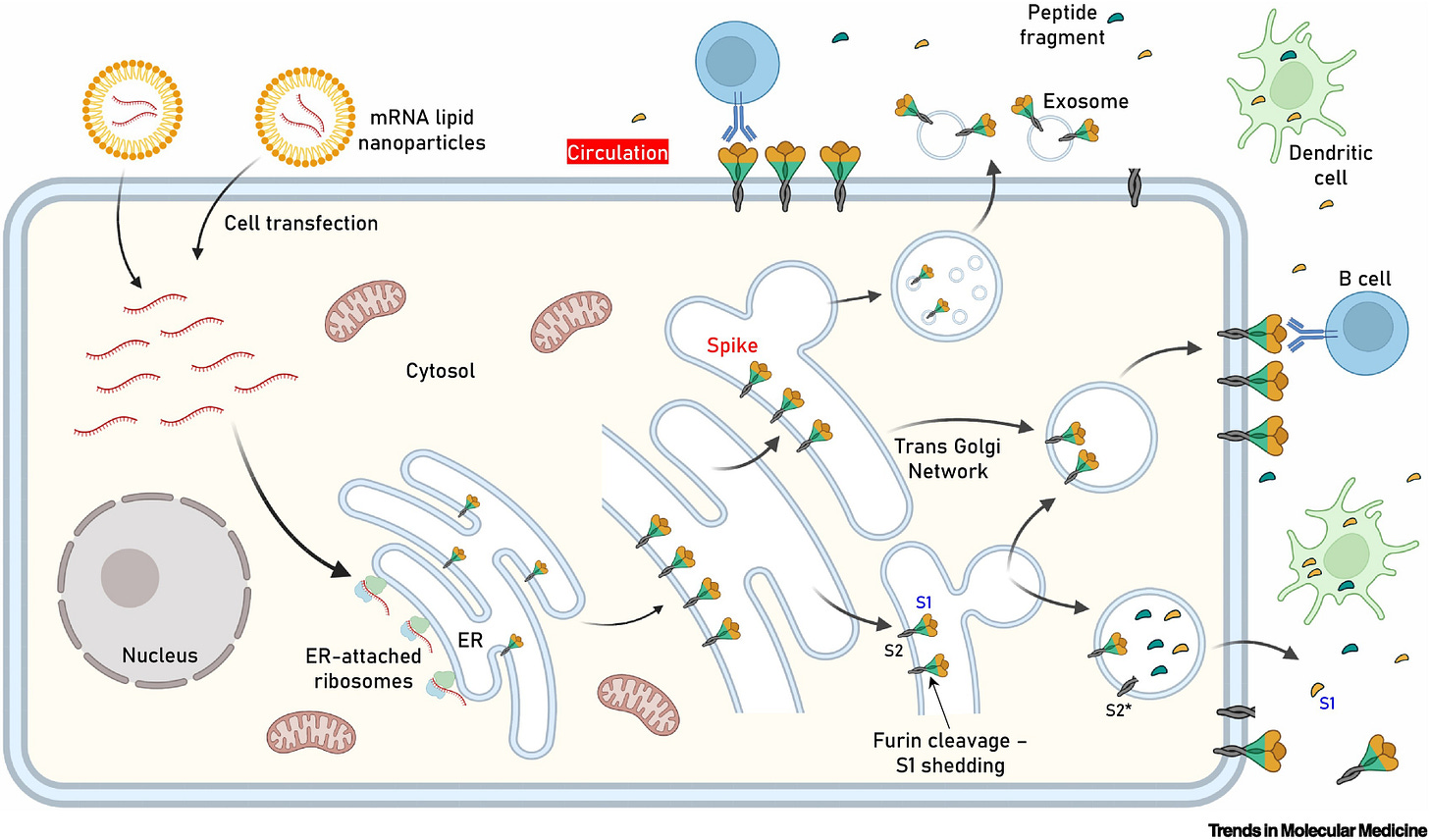
Obr. 1: Kľúčový obrázok. Lokalizácia expresie antigénu po transfekcii buniek mRNA obsahujúcou proteín hrotu (S), ktorá sa používa vo vakcínach proti akútnemu respiračnému syndrómu s koronavírusom 2 (SARS-CoV-2) s mRNA.
Po internalizácii LNP a uvoľnení mRNA autentický vírusový signálny peptid (ako vo vakcínach Pfizer-BioNTech a Moderna) poháňa produkciu antigénu v lúmene endoplazmatického retikula (ER), kde nadobúda svoju prirodzenú transmembránovú lokalizáciu prostredníctvom ukotvenia podjednotky 2 (S2). Po vytriedení v trans Golgiho sieti (TGN) získava proteín S svoju konečnú pozíciu v transfúznej membráne ľudskej bunky, kde je S1 vystavený extracelulárnemu priestoru (t.j. môže smerovať do obehu). Hoci rozsah expresie antigénu na bunku zostáva neznámy, je možné predpokladať, že tento proces má za následok pomerne rozsiahlu výzdobu transfekovaných buniek proteínom S. Furínom sprostredkované proteolytické štiepenie (ako v bunkách infikovaných SARS-CoV-2) v neprítomnosti mutovaného miesta štiepenia S1/S2 furínom v TGN môže viesť k vylúčeniu štiepeného S1 a premene S2 na jeho postfúznu štruktúru (S2*). Triedenie antigénu a obchodovanie s ním môže tiež indukovať uvoľňovanie exozómov obsahujúcich proteín S. K uvedeným udalostiam dôjde na apikálnom a/alebo bazolaterálnom povrchu polarizovaných (napr. epitelových) buniek. Konštrukcie Pfizer-BioNTech a Moderna neobsahujú mutované miesto štiepenia furínu S1/S2. Ďalší výskum objasní vplyv mutácie D614G (alebo inej) stabilizujúcej podjednotky S1/S2 alebo mutovaného miesta štiepenia furínu na distribúciu antigénu, imunogenitu vakcíny a vyvolané nežiaduce udalosti (AE). Zobrazené sú aj dendritické bunky (profesionálne antigén-prezentujúce bunky, APC) pohlcujúce cirkulujúce antigény a protilátkami sprostredkovaná väzba B-buniek na antigény ukotvené v bunkách.
Keďže dodané mRNA môžu teoreticky spustiť produkciu odlišných antigénov, ktoré sa môžu distribuovať systémovo [20.], radikálne sa líšia od konvenčných platforiem (t.j. inaktivovaných celovírusových vakcín alebo dokonca vakcín s proteínovými podjednotkami nanočastíc) (box 2), kde sú produkovaný antigén a jeho distribúcia predvídateľnejšie. Keďže všetky vakcíny proti COVIDu-19 sa spoliehajú na proteín S pôvodného kmeňa Wuhan-Hu-1 [19.,20.], rozdiely medzi rôznymi doteraz uvedenými vakcinačnými platformami (box 2) sa môžu týkať rôznych vektorov a formulácií a/alebo použitých konštruktov proteínu S.
BOX 2
Iné typy vakcíny proti COVIDu-19
Pri vakcínach s vírusovými vektormi sa informácia kódujúca S proteín dodáva prostredníctvom adenovírusového vektorového systému s nedostatočnou replikáciou, ktorý obsahuje kódujúcu dsDNA. V tomto prípade sa transkripty z adenovírusových vektorov vytvárajú v bunkovom jadre. Tu je hlavným hláseným AE imunitný tromboembolizmus (vrátane trombózy mozgových venóznych dutín) v rôznych orgánoch, pravdepodobne prostredníctvom nadmernej vrodenej imunitnej sústavy a aktivácie endotelu [138.]. Okrem samotného proteínu S možno AE pripísať aj expresii zvyšných adenovírusových génov v pozadí alebo pretrvávajúcej DNA adenovírusového vektora v transkripčne aktívnej forme. Ďalšie obavy sa týkajú prítomnosti iných kontaminujúcich proteínov, zvyškov výrobnej linky vakcíny a už existujúcej antivírovej imunity [20.]; tento posledný problém sa netýka rekombinantnej vakcíny ChAdOx1-S (Oxford-AstraZeneca), ktorá využíva iný ako ľudský adenovírusový vektor. Dôležitejšie je, že infekčný cyklus vírusu SARS-CoV-2 prebieha výlučne v cytoplazme, a preto v jeho génoch neexistuje evolučný tlak proti prítomnosti darcovských a akceptorových miest na spájanie. To je zásadný rozdiel oproti vakcínam s mRNA, ktoré fungujú v cytoplazme, pretože rôzne zostrihané transkripty z adenovírusových vektorov sa môžu vytvárať v bunkovom jadre [56.].
V proteínových podjednotkových nanočasticových vakcínach (napr. NVX-CoV2373) sa proteín S získava v systéme bunkovej kultúry, purifikuje sa a dodáva sa ako trimer prostredníctvom zostavy nanočastíc v adjuvans. Hoci predbežné skúšky naznačujú, že tieto vakcíny môžu vyvolať silnú imunitu [139.], správy o nežiaducich účinkoch sú stále nedostatočné vzhľadom na obmedzené množstvo údajov o očkovaní.
Napokon, v konvenčných vakcínach sa celý vírus inaktivuje a inokuluje pomocou vhodného adjuvantu [26.]. Významnou výhodou je, že zatiaľ čo v predchádzajúcich diskutovaných technológiách je S proteín jediným zdrojom imunogénnych epitopov, v tomto prípade sa prezentuje široký repertoár epitopov v iných vírusových proteínoch. Medzi možné nevýhody patrí nižšia imunogenita, problémy s výrobou, nežiaduce účinky spôsobené použitým adjuvansom (napr. hydroxidom hlinitým), ako aj problémy, ktoré súvisia s neúplnou inaktiváciou vírusu. Vzhľadom na to, že tieto vakcíny nedosiahli masovú výrobu, neexistujú správy o možných nežiaducich účinkoch.
Anti-SARS-CoV-2 mRNA vakcíny a ich hlásené nežiaduce účinky
Vakcíny BNT162b2 aj mRNA-1273 sa podávajú intramuskulárne a mobilizujú robustné a pravdepodobne trvalé vrodené, humorálne a bunkové adaptačné imunitné odpovede [27., 28., 29., 30.]. Existujúce údaje o dostupných mRNA vakcínach sú väčšinou obmedzené na sérologické analýzy. Napriek tomu je okrem hodnotenia imunitných reakcií rozhodujúce aj pochopenie bezpečnostného profilu týchto vakcín, aby sa zabezpečila bezpečnosť, zachovala dôvera a informovala politika. Uvádza sa, že mRNA vakcíny sú vo všeobecnosti dobre tolerované, s veľmi nízkou frekvenciou súvisiacich závažných postimunizačných nežiaducich účinkov. Aj keď sú zriedkavé, medzi nežiaduce účinky patria závažné klinické prejavy, ako je akútny infarkt myokardu, Bellova obrna, trombóza mozgových žíl, Guillainov-Barrého syndróm, myokarditída/perikarditída (väčšinou v mladšom veku), pľúcna embólia, cievna mozgová príhoda, trombóza so syndrómom trombocytopénie, lymfadenopatia, apendicitída, reaktivácia herpes zoster, neurologické komplikácie a autoimunita (napr. autoimunitná hepatitída a autoimunitné periférne neuropatie [31., 32., 33., 34.]) (pozri Kútik lekára). Okrem AE zdokumentovaných v klinických štúdiách bola väčšina syndrómov alebo izolovaných prejavov hlásená v multicentrických alebo dokonca celoštátnych retrospektívnych observačných štúdiách a sériách prípadov. Hoci korelácia nemusí nevyhnutne znamenať kauzalitu, aktívne monitorovanie a informovanosť v súvislosti s hlásenými postvakcinačnými AE sú nevyhnutné. Dôležité je, že tieto pridružené AE sú podstatne menej časté ako analogické alebo ďalšie závažné AE vyvolané po závažnom COVIDe-19 [31.,32.,34.]. Zistilo sa, že niektoré AE vyvolané očkovaním (napr. infarkt myokardu, Guillainov-Barrého syndróm) sa zvyšujú s vekom, zatiaľ čo iné (napr. myokarditída, anafylaxia, apendicitída) boli častejšie u mladších ľudí [35.,36.]. Hoci sú prípady myokarditídy pomerne zriedkavé, v štúdii amerického vojenského personálu bol ich počet u mužov po druhej dávke vakcíny vyšší, ako sa očakávalo [37.]; podobne bol počet postvakcinačných kardiálnych AE vyšší u mladých chlapcov po druhej dávke [38.,39.]. Napokon, nedávna štúdia preukázala zvýšené riziko neurologických komplikácií u príjemcov vakcíny proti COVIDu-19 (ktoré však bolo nižšie ako riziko u pacientov s COVIDom-19) [34.]. Molekulárna podstata týchto nežiaducich účinkov zostáva z veľkej časti neznáma. Predpokladáme, že keďže väčšina z nich (ak nie všetky) sa prejavuje aj pri ťažkom COVIDe-19 [31.], môžu súvisieť s akútnym zápalom spôsobeným vírusom aj vakcínou, ako aj v spoločnom menovateli vírusu a vakcíny, a to v proteíne S SARS-CoV-2 (box 1). Vakcínou kódovaný antigén (proteín S) je vo vakcínach BNT162b2 a mRNA-1273 stabilizovaný vo svojej prefúznej forme [19.,20.]; je preto pravdepodobné, že ak sa dostane do obehu a distribuuje sa systémovo v ľudskom tele (obrázok 2), môže prispieť k týmto AE u vnímavých jedincov.
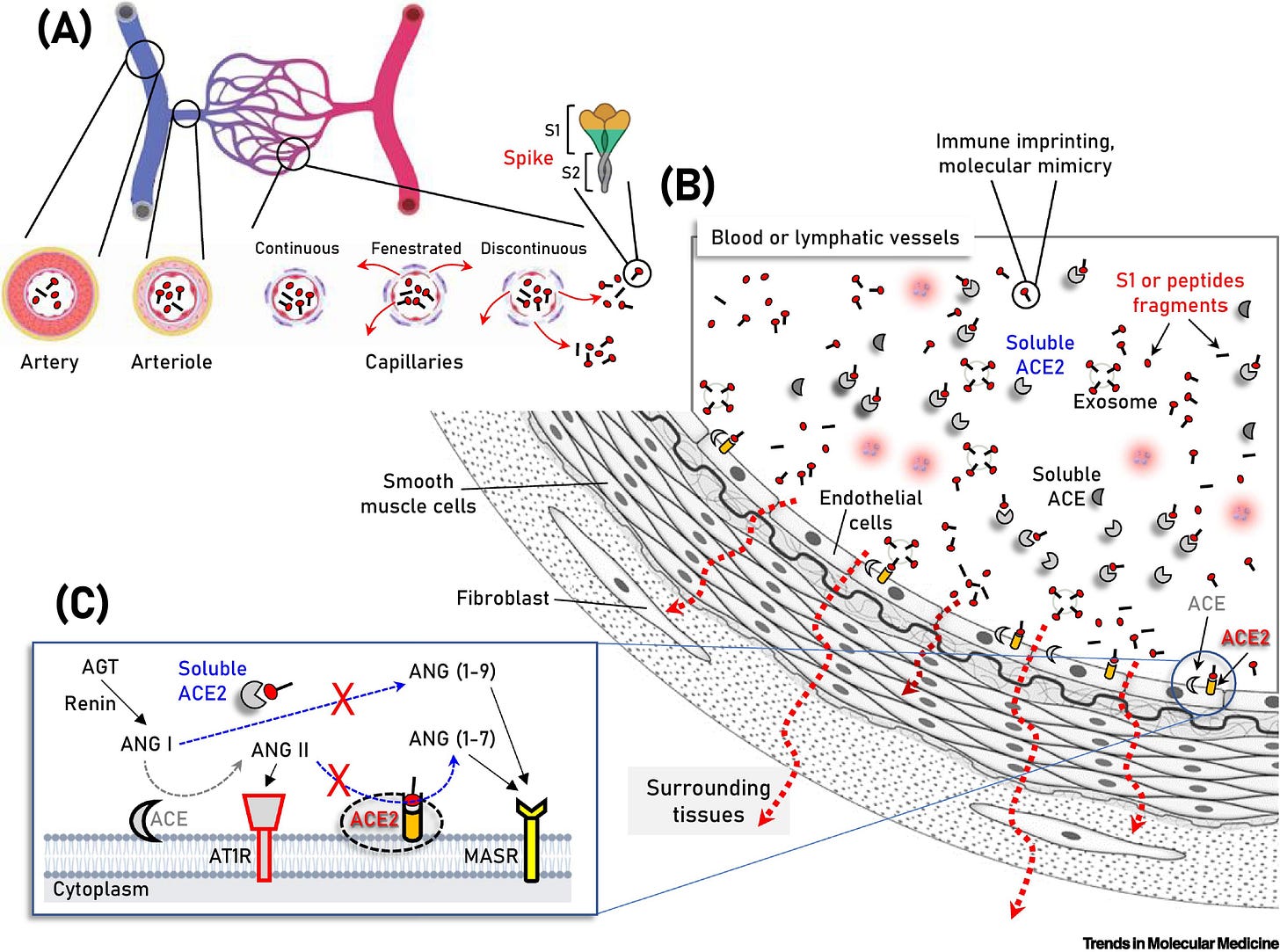
Obr. 2: Schematické znázornenie zložiek cievneho riečiska, na ktorom sú znázornené vakcináciou vyprodukované S proteíny/podjednotky/peptidové fragmenty v cirkulácii, ako aj rozpustný alebo na membránu endotelových buniek naviazaný angiotenzín konvertujúci enzým 2 (ACE2).
(A,B) Súbežne s aktiváciou imunitného systému môže dôjsť k naviazaniu cirkulujúcich S proteínov/podjednotiek/peptidových fragmentov (B) na ACE2 nielen na endotelové bunky exprimujúce ACE2, ale aj na viaceré typy buniek vaskulatúry a okolitých tkanív v dôsledku difúzie antigénu (napr. vo fenestrovaných alebo prerušovaných kapilárnych lôžkach) (A, červené šípky). Tieto série molekulárnych udalostí sú nepravdepodobné pre akýkoľvek antigén súvisiaci s ťažkým akútnym respiračným syndrómom koronavírusu 2 (SARS-CoV-2) v prípade neprítomnosti ťažkého koronavírusového ochorenia 2019 (COVID-19), kde je SARS-CoV-2 obsiahnutý v dýchacom systéme. Na obrázku (C) sú znázornené dve protichodné dráhy systému renín-angiotenzín (RAS), a to "konvenčné" rameno, ktoré zahŕňa ACE, ktoré generuje angiotenzín II (ANG II) z angiotenzínu I (ANG I), a rameno ACE2, ktoré hydrolyzuje ANG II za vzniku angiotenzínu (1-7) [ANG (1-7)] alebo ANG I za vzniku angiotenzínu (1-9) [ANG (1-9)]. Väzba ANG II a aktivácia receptora ANG II typu 1 (AT1R) podporuje zápal, fibrotickú remodeláciu a vazokonstrikciu, zatiaľ čo peptidy ANG (1-7) a ANG (1-9) viažuce sa na receptor MAS (MASR) aktivujú antifibrotické, protizápalové cesty a vazodilatáciu. Zobrazené sú aj ďalšie moduly RAS (t. j. renín a angiotenzinogén, AGT). Skratky: RAS, RAS, RAS, RAS, RAS, RAS, RAS, RAS, RAS, RAS, RAS, RAS, RAS, RAS, RAS: AT1R, receptor angiotenzínu II typu 1.
Existujú aj dôkazy, že ionizovateľné lipidy v LNP môžu spúšťať prozápalové reakcie aktiváciou receptorov podobných Toll (TLR) [40.]. Nedávna správa ukázala, že LNP používané v predklinických štúdiách vakcín s nukleozidom modifikovanou mRNA sú (nezávisle od spôsobu doručenia) u myší vysoko zápalové, čo sa prejavuje nadmernou infiltráciou neutrofilov, aktiváciou rôznych zápalových dráh a produkciou rôznych zápalových cytokínov a chemokínov [41.]. Toto zistenie by mohlo vysvetliť silnú adjuvantnú aktivitu LNP, ktorá podporuje indukciu silných adaptívnych imunitných reakcií [24.]. Zaujímavé je, že zápalové reakcie sa môžu zhoršiť na pozadí už existujúcich zápalových stavov, ako sa nedávno ukázalo na myšom modeli po podaní mRNA-LNPs [42.]; tento účinok sa ukázal ako špecifický pre LNP, pôsobiaci nezávisle od nákladu mRNA.
Hoci chemické modifikácie v molekulách RNA používaných vo vakcínach (podrobne opísané predtým) majú za cieľ znížiť TLR detekciu vonkajších jedno-reťazcových RNA (a tým aj prozápalových signálov), existujú určité dôkazy, že modifikované uracilové zvyšky úplne nezrušujú TLR detekciu mRNA; takisto, hoci sa vynakladá úsilie na zníženie produkcie dvoj-reťazcovej (ds) RNA, môže existovať malé množstvo dsRNA, ktoré sa môže príležitostne dostať do balíčkov v rámci mRNA vakcín [26.].
V tomto kontexte môže častá posilňovacia imunizácia zvýšiť frekvenciu a/alebo závažnosť hlásených AE.
Distribúcia vakcínou zakódovaného antigénu v ľudskom tele a možné interakcie s ľudskými proteínmi
Po očkovaní môže bunka prezentovať vyrobený S proteín (alebo jeho podjednotky / peptidové fragmenty), ktorý mobilizuje imunitné reakcie alebo ho imunitný systém (napr. cytotoxické T bunky) zruší [25.]. Následne sa z vyprodukovaných zvyškov alebo dokonca priamym vylučovaním (vrátane vylučovania) antigénu transfokovanými bunkami môže uvoľniť veľké množstvo proteínu S alebo jeho podjednotiek / peptidových fragmentov do obehu (obrázok 1) [19.,20.]. LNP obsahujúce mRNA vakcíny anti-SARS-CoV-2 sa vstreknú do deltového svalu a pôsobia v samotnom svalovom tkanive, lymfatickom systéme a slezine, ale môžu sa lokalizovať aj v pečeni a iných tkanivách [21.,22.,43.,44.], odkiaľ sa proteín S alebo jeho podjednotky / peptidové fragmenty môžu dostať do obehu a distribuovať sa do celého tela. Je potrebné spomenúť, že lokalizácia LNP v pečeni nie je univerzálnou vlastnosťou nosných nanočastíc, pretože špecifické modifikácie v ich chemickom zložení môžu zachovať imunogenitu s minimálnym zapojením pečene [43.,45.]. V súlade s pravdepodobnou systémovou distribúciou antigénu sa zistilo, že proteín S cirkuluje v plazme príjemcov vakcíny BNT162b2 alebo mRNA-1273 už 1. deň po prvej injekcii vakcíny [46.]. Uvádza sa, že klírens antigénu je v korelácii s produkciou antigén-špecifických imunoglobulínov alebo môže zostať v cirkulácii (napr. v exozómoch) dlhší čas [47.,48.], čo poskytuje jedno z rozumných vysvetlení (okrem iných) pre robustné a trvalé systémové imunitné odpovede zistené u očkovaných príjemcov [49.,50.]. Preto je pravdepodobné, že medzi voľne sa pohybujúcimi S proteínmi / podjednotkami / peptidovými fragmentmi a ACE2 cirkulujúcim v krvi (alebo lymfe) alebo ACE2 exprimovaným v bunkách z rôznych tkanív / orgánov (obrázok 2) existuje rozsiahla škála očakávaných interakcií [14., 15., 16.]. Túto predstavu podporuje aj zistenie, že v adenovírusovo-vakcínach (box 2) má S proteín produkovaný pri vakcinácii natívne podobnú mimikry receptorovej väzbovej funkcie a prefúznej štruktúry S proteínu SARS-CoV-2 [51.].
Môžu sa vyskytnúť ďalšie interakcie s ľudskými proteínmi v obehu alebo dokonca prezentácia antigénnych epitopov proteínu S [52.] napodobňujúcich ľudské proteíny (molekulárna mimikry) imunitnému systému [53., 54., 55., 56.]. Uvádza sa, že niektoré z takmer germinálnych SARS-CoV-2 NAbs proti S doméne viažucej receptor (RBD) reagovali so samoantigénmi cicavcov [57.] a SARS-CoV-2 S antagonizuje vrodenú antivírusovú imunitu tým, že sa zameriava na viaceré dráhy kontrolujúce produkciu interferónu (IFN) [58.]. Takisto sa zistilo trvalé zvýšenie odpovedí T-buniek na mRNA vakcíny SARS-CoV-2 (údaje zatiaľ neboli recenzované) u pacientov, ktorí trpia chronickými neurologickými príznakmi po akútnej infekcii SARS-CoV-2 v porovnaní so zdravými rekonvalescentmi po COVIDe-19 [59.]. Vzhľadom na hlásené (zriedkavé) neurologické nežiaduce účinky po očkovaní sa navrhlo, že sú potrebné ďalšie štúdie na posúdenie, či protilátky proti vakcínou produkovaným antigénom môžu skrížene reagovať so zložkami periférnych nervov [34.]. Medzi ďalšie obavy patrí možný vznik anti-idiotypových protilátok proti vakcináciou indukovaným protilátkam ako prostriedku downregulácie; anti-idiotypove protilátky – okrem väzby na ochranné neutralizačné protilátky SARS-CoV-2 – môžu tiež zrkadliť samotný S proteín a viazať ACE2, čo môže vyvolať širokú škálu AE [60.]. Za zmienku stojí systémový vakcinologický prístup (31 jedincov) účinkov vakcíny BNT162b2 (dve dávky), kde anticytokínové protilátky zväčša chýbali alebo sa vyskytovali v nízkych hladinách (na rozdiel od zistení pri akútnom COVIDe-19 [61.,62.]), zatiaľ čo dvaja jedinci mali autoprotilátky proti interleukínu-21 (IL-21) a dvaja ďalší jedinci mali protilátky proti IL-1 [63.]. V tomto kontexte sa antiidiotypové protilátky môžu zvýšiť najmä po častých posilňujúcich dávkach, ktoré vyvolávajú veľmi vysoké titre imunoglobulínov [64.]. Časté posilňovacie dávky sa môžu stať aj suboptimálnym prístupom, pretože môžu vtisnúť sérologickú odpoveď voči predkovskému proteínu S Wuhan-Hu-1, čím sa minimalizuje ochrana proti novým variantom vírusu S [65.,66.].
Potenciálna interakcia na úrovni celého organizmu proteínu S podobného natívnemu a/alebo podjednotiek / peptidových fragmentov s rozpustným alebo na bunkovej membráne pripojeným ACE2 (obrázok 2) môže podporiť internalizáciu a degradáciu ACE2 [67.,68.]. Na podporu toho rozpustný ACE2 indukuje receptorom sprostredkovanú endocytózu SARS-CoV-2 prostredníctvom interakcie s proteínmi súvisiacimi s RAS [69.]. Dlhodobá strata alebo znížená aktivita ACE2 môže mať za následok rozsiahlu destabilizáciu RAS, ktorá potom môže vyvolať vazokonstrikciu, zosilnený zápal a/alebo trombózu v dôsledku nepotlačených účinkov ACE a angiotenzínu-2 (ANG II) (obrázok 2) [13.]. Znížená expresia a/alebo aktivita ACE2 totiž okrem iného prispieva k rozvoju hypertenzie sprostredkovanej ANG II u myší, čo poukazuje na dysfunkciu ciev [67.]. Základné úrovne expresie ACE2 v endotelových bunkách alebo úrovne jeho indukovanej expresie po stimulácii inými tkanivovými rezidentnými bunkami spolu s potenciálom endotelových buniek vylučovať ACE2 do cirkulácie alebo ich citlivosť na infekciu SARS-CoV-2 sú diskutabilné [70., 71., 72., 73.]. Napriek tomu aj relatívne nízke hladiny expresie ACE2 v endotelových bunkách (napr. v porovnaní s hladinami v epitelových bunkách) [15.,16.,70.,71.] spolu s vysokými hladinami expresie ACE2 v iných typoch buniek vaskulatúry (napr. v srdcových fibroblastoch/pericytoch) [15.,74.] naznačujú, že vaskulatúra môže byť citlivá na voľne sa pohybujúci S proteín alebo jeho podjednotky/peptidové fragmenty (obrázok 2). Tieto účinky, najmä v kapilárnych lôžkach, a dlhodobá prítomnosť antigénu v cirkulácii [46., 47., 48.] spolu so systémovou nadmernou imunitnou odpoveďou na antigén môžu potom vyvolať trvalý zápal (o ktorom sa bude hovoriť neskôr), ktorý môže poškodiť endotel a narušiť jeho antitrombogénne vlastnosti vo viacerých cievnych lôžkach.
Účinky vyvolané proteínom S SARS-CoV-2 v bunkách cicavcov alebo modelových organizmoch
Údajne intravenózna (i.v.) injekcia podjednotky S1 u myší vedie k jej lokalizácii v endoteloch myších mozgových mikrovaskulárnych ciev, ktoré vykazujú kolokalizáciu s ACE2, kaspázou-3, IL-6, tumor nekrotizujúcim faktorom α (TNF-α) a C5b-9; preto sa predpokladá, že poškodenie endotelu je hlavnou súčasťou patológie SARS-CoV-2, ktorú môže vyvolať samotný proteín S [75.]. Takisto podjednotka S1 (alebo rekombinantná S1 RBD) zhoršila funkciu endotelu prostredníctvom downregulácie ACE2 [76.] a indukovala degradáciu junkčných proteínov, ktoré udržiavajú integritu endotelovej bariéry v modeli myších mikrovaskulárnych endotelových buniek mozgu alebo mozgových artérií; tento druhý účinok bol výraznejší v endotelových bunkách z diabetických myší v porovnaní s normálnymi [77.]. Podobne podjednotka S1 znížila mikrovaskulárnu transendotelovú rezistenciu a bariérovú funkciu v kultivovaných ľudských pľúcnych bunkách [78.]. Ďalej proteín S narušil funkciu ľudských srdcových pericytov a vyvolal zvýšenú produkciu proapoptotických faktorov v pericytoch, čo spôsobilo smrť endotelových buniek [79.]. Na podporu tohto tvrdenia podávanie proteínu S podporovalo dysfunkciu ľudských endotelových buniek, o čom svedčí napríklad zvýšená expresia von Willebrandovho faktora [80.]. Iné správy naznačujú, že S1 môže priamo indukovať koaguláciu kompetitívnou väzbou na rozpustný aj bunkový heparan sulfát / heparín (antikoagulant) [81., 82., 83., 84.], zatiaľ čo bezbunkový hemoglobín ako protiváha hypoxie nedokáže zmierniť narušenie funkcie endotelovej bariéry, oxidačný stres alebo zápalové reakcie v endotelových bunkách ľudských pľúcnych artérií vystavených S1 [85.]. Dôsledne sa na proteín S viaže fibrinogén (faktor zrážania krvi) a zistilo sa, že virióny proteínu S zvyšujú fibrínom sprostredkovanú aktiváciu mikroglie (údaje zatiaľ neboli recenzované) a vyvolávajú pľúcnu patológiu závislú od fibrinogénu u myší [86.], zatiaľ čo väzba S1 na ACE2 krvných doštičiek spúšťa ich agregáciu [84.]. Je zaujímavé, že vakcíny ChAdOx1 (AstraZeneca) aj BNT162b2 môžu vyvolať tvorbu protilátok proti faktoru 4 (anti-PF4) aj u príjemcov bez klinických prejavov trombózy [87.].
Zaujímavé je, že proteín S zvyšuje tvorbu syncytií ľudských buniek [88.,89.], pričom spúšťa pyroptózu syncytií vytvorených fúziou buniek exprimujúcich S a ACE2 [90.]. Taktiež sa na bunkách alebo myších experimentálnych modeloch ukázalo, že S odstraňuje lipidy z modelových membrán a narúša schopnosť lipoproteínov s vysokou hustotou vymieňať lipidy [91.], inhibuje procesy opravy poškodenia DNA [92.] a indukuje zmeny markerov epiteliálno-mezenchymálneho prechodu sprostredkované Snail a metastázovanie pľúc na myšom modeli rakoviny prsníka [93.].
Na podporu možnosti, že existuje široká škála viazačov proteínu S, sa zistilo, že Aβ1-42 (42 aminokyselinová forma amyloidu β v mozgovomiechovom moku) sa s vysokou afinitou viaže na podjednotku S1 a ACE2 [94.]. Aβ1-42 posilnil väzbu S1 na ACE2 a zvýšil vstup vírusu a produkciu IL-6 na modeli myši s pseudovírusovou infekciou SARS-CoV-2. Údaje z tohto náhradného modelu myší s intravenóznou inokuláciou Aβ1-42 ukázali, že klírens Aβ1-42 v krvi bol tlmený v prítomnosti extracelulárnej domény trimrov proteínu S [94.]. Vzhľadom na širokú expresiu ACE2 v ľudskom mozgu [95.] štúdia, ktorá bola obzvlášť zaujímavá, ukázala, že intravenózne injikovaný rádioaktívny jódovaný S1 (I-S1) ľahko prechádza adsorpčnou transcytózou cez hematoencefalickú bariéru u myších samcov, je vychytávaný oblasťami mozgu a dostáva sa do parenchymatického priestoru mozgu. I-S1 bol tiež vychytávaný pľúcami, slezinou, obličkami a pečeňou; intranazálne podaný I-S1 sa tiež dostal do mozgu, hoci v nižších hladinách ako po i.v. podaní [96.]. Podobne sa zistilo, že S1 narušuje integritu hematoencefalickej bariéry na 3D mikrofluidickom modeli hematoencefalickej bariéry [97.]. Na podporu tohto tvrdenia štúdie biodistribúcie platformy mRNA-LNP spoločnosti Moderna u potkanov Sprague Dawley odhalili prítomnosť nízkych hladín mRNA v mozgu, čo naznačuje, že mRNA-LNP môžu prechádzať hematoencefalickou bariérou [22.].
Napokon, nedávno bolo oznámené, že ľudské T-lymfocyty exprimujú ACE2 na úrovniach dostatočných na interakciu s proteínom S [98.], pričom sa už predtým ukázalo, že SARS-CoV-2 využíva CD4 na infikovanie pomocných T-lymfocytov a že S podporuje prozápalový aktivačný profil na najsilnejších antigén-prezentujúcich bunkách (APC) (t.j. ľudských dendritických bunkách) [99.]. Ak sa tieto pozorovania potvrdia, môžu vysvetliť AE sprostredkovaný vakcináciou proti SARS-CoV-2, konkrétne reaktiváciu vírusu varicella zoster [100.,101.].
Prozápalové reakcie vyvolané proteínom S a jedinečné podpisy expresie génov po očkovaní
Uvádza sa, že S proteín (okrem už spomínanej platformy LNP-mRNA) sprostredkúva prozápalové a/alebo poškodené (rôznej etiológie) reakcie v rôznych typoch ľudských buniek [102., 103., 104.] a ACE2 sprostredkovaná infekcia ľudských bronchiálnych epiteliálnych buniek pseudoviriónmi S proteínu vyvolala zápal a apoptózu [105.]. Taktiež S proteín podporoval zápalovú cytokínovú odpoveď IL-6/IL-6R indukovanú trans signalizáciou a sekréciu alarminu v ľudských endotelových bunkách spolu so zvýšeným oxidačným stresom, indukciou zápalovej parakrinnej senescencie a vyššou úrovňou adhézie leukocytov [106.]. Iné správy naznačujú, že proteín S spúšťa zápalovú odpoveď v ľudských epitelových bunkách rohovky [107.], zvyšuje oxidačný stres a zlomy DNA ds v ľudských mononukleárnych bunkách periférnej krvi (PBMC) po očkovaní [108.] a viaže sa na lipopolysacharid, čím zvyšuje jeho prozápalovú aktivitu [109.,110.]. Okrem toho proteín S indukuje neurozápal a aktiváciu kaspázy-1 v bunkách mikroglie BV-2 [111.] a blokuje neuronálne vystreľovanie v senzorických neurónoch [112.]. Systémový zápal vyvolaný proteínom S môže prebiehať prostredníctvom aktivácie dráhy nukleárneho faktora κB (NF-κB) závislej od TLR2 [113. ], zatiaľ čo výpočtové modely založené na štruktúre ukázali, že S proteín vykazuje vysoko afinitný motív na väzbu T bunkových receptorov (TCR) a môže tvoriť ternárny komplex s molekulami histokompatibilného komplexu II. triedy; analýza repertoáru TCR u pacientov s COVID-19 totiž ukázala, že tí s ťažkým hyperzápalovým ochorením vykazujú skreslenie TCR v súlade s aktiváciou superantigénu (S proteínu) [114.]. Na myšacích modeloch in vivo S proteín aktivoval makrofágy a prispel k indukcii akútneho zápalu pľúc [115.], zatiaľ čo intratracheálna instilácia podjednotky S1 u transgénnych myší nadmerne exprimujúcich ľudský ACE2 vyvolala závažné akútne poškodenie pľúc a zápal podobný COVIDu-19. Tieto účinky boli miernejšie u myší divokého typu, čo poukazuje na závislosť fenotypu od expresie ľudského ACE2 [78.]. Dôsledne sa zistilo, že podjednotka S1 pôsobí ako PAMP, ktorá prostredníctvom zapojenia receptora rozpoznávania vzorov vyvoláva u dospelých potkanov neurozápal nezávislý od vírusovej infekcie [116.].
Tieto pozorovania korelujú so zistením systémového zápalového podpisu po prvej vakcinácii BNT162b2, ktorý bol sprevádzaný zvýšením TNF-α a IL-6 po druhej dávke [117.]; tieto účinky môžu tiež súvisieť s prozápalovým pôsobením platformy mRNA-LNP (pozri skôr). V dôkladnej systémovej vakcinologickej štúdii účinkov mRNA vakcíny BNT162b2 mali mladší účastníci tendenciu mať väčšie zmeny v monocytových a zápalových moduloch 1 deň po druhej dávke, zatiaľ čo starší jedinci mali zvýšenú expresiu modulov B a T buniek. Okrem toho analýza transkriptomiky jednotlivých buniek v tom istom časovom bode odhalila vznik jedinečného zhluku myeloidných buniek z celkovo 18 identifikovaných zhlukov buniek. Tento zhluk buniek nepredstavuje myeloidné supresorové bunky, exprimoval gény stimulované IFN a nenašiel sa pri infekcii COVIDu-19; tiež bol podobný epigeneticky preprogramovanej populácii monocytov, ktorá sa našla v krvi darcov očkovaných dvoma dávkami vakcíny proti chrípke [63.]. To, či je epigenetické preprogramovanie základom zvýšenej génovej odpovede vyvolanej IFN v bunkách C8 po sekundárnej vakcinácii BNT162b2, treba ešte objasniť. Napokon, porovnanie znakov expresie génov vyvolaných vakcínou BNT162b2 na 7. deň po podaní primárnej (d7PP) a post-boost (d7PB) dávky s inými typmi vakcín (napr. inaktivovanými alebo živými atenuovanými vakcínami) vykazovalo slabú koreláciu medzi d7PP a d7PB, ako aj s inými vakcínami [63.]. Tieto zistenia naznačujú vývoj nových genomických reakcií po druhej dávke a, čo je dôležitejšie, jedinečnú biológiu mRNA vakcín v porovnaní s inými konvenčnejšími platformami. Mimoriadne zaujímavá je aj správa o syndróme uvoľňovania cytokínov (CRS) – mimoriadne zriedkavom imunitnom nežiaducom účinku inhibítorov kontrolných bodov imunity – po očkovaní vakcínou BTN162b2 u pacienta s kolorektálnym karcinómom na dlhodobej monoterapii antiprogramovanou smrťou 1 (PD-1); o CRS sprostredkovanom anti-PD1 blokádou svedčili zvýšené zápalové markery, trombocytopénia, zvýšené hladiny cytokínov a reakcia na steroidy [118.]. Tieto prozápalové účinky by mohli byť obzvlášť výrazné u starších ľudí, keďže nedávne údaje odhalili, že senescentné bunky sa v reakcii na podjednotku S1 stávajú hyperzápalovými, po čom nasleduje zvýšená expresia vstupných proteínov vírusu a znížená expresia antivírusových génov v nesenescentných bunkách prostredníctvom parakrinného mechanizmu [119.].
Je potrebné preskúmať molekulárny základ AE vyvolaných očkovaním
Anti-SARS-CoV-2 mRNA vakcíny vyvolávajú trvalú a silnú systémovú imunitu, a preto je ich prínos pri zmierňovaní pandémie COVID-19 a záchrane tisícov životov nepochybný. Táto technológia má oproti konvenčným vakcínam niekoľko výhod [120.] a otvára úplne novú éru vývoja nových vakcín proti rôznym infekčným a iným ochoreniam vrátane rakoviny. Na základe v súčasnosti dostupných molekulárnych poznatkov (väčšinou v testoch na báze buniek a modelových organizmov) predpokladáme, že zriedkavé AE hlásené po očkovaní vakcínami s mRNA kódujúcou proteín S môžu súvisieť s povahou a väzbovým profilom systémovo cirkulujúceho antigénu (antigénov) (obrázok 1, obrázok 2), hoci príspevok LNP a/alebo dodanej mRNA je pravdepodobne tiež významný [24.,26.,41.]. Preto by sa mala dôkladne preskúmať možnosť subklinickej orgánovej dysfunkcie u očkovaných príjemcov, ktorá by mohla zvýšiť riziko napríklad budúcich (kardiovaskulárnych) alebo zápalových ochorení. Vzhľadom na to, že závažný COVID-19 koreluje s vyšším vekom, hypertenziou, diabetom a/alebo kardiovaskulárnymi ochoreniami, ktoré majú spoločný variabilný stupeň deregulácie signálu ACE2, môže dodatočná downregulácia ACE2 vyvolaná očkovaním ešte viac zosilniť nevyrovnaný RAS. Pokiaľ ide o lokalizáciu LNP v pečeni a následnú expresiu antigénov, je potrebné spomenúť, že pečeň je neustále vystavená množstvu vlastných a cudzích antigénov a môže vytvárať účinné imunitné odpovede proti patogénom, pretože hostí konvexné APC (napr. dendritické bunky, B bunky a Kupferove bunky). Ďalšie typy pečeňových buniek – ako sú pečeňové sinusoidálne endotelové bunky, pečeňové hviezdicové bunky a hepatocyty – majú tiež schopnosť pôsobiť ako APC [121.]. Je pravdepodobné, aj keď zatiaľ nedokázané, že keďže proteín S sa produkuje v pečeňových bunkách, konvenčné aj nekonvenčné APC môžu byť základom adaptívnych, ale aj vrodených imunitných reakcií v imunologickej nike pečene. Napriek hlavnej tolerogénnej úlohe pečene [122.] môže trvalá expresia antigénov súvisiacich s proteínom S (obrázok 1) potenciálne vychýliť imunitnú odpoveď smerom k autoimunitnému poškodeniu tkaniva, ako v pozorovaných prípadoch autoimunitnej hepatitídy po očkovaní [123.,124.]. Preto si zaslúži ďalšie skúmanie, či LNP môžu transfekovať akékoľvek iné neimunologické telesné tkanivá nesúce bunky, ktoré môžu pôsobiť ako nekonvenčné APC, a tak vyvolať trvalú imunitnú odpoveď, ale aj samoreakciu, ako v prípadoch chronických vírusových infekcií [125.].
Záverečné poznámky
Hoci pomer prínosu a rizika zostáva výrazne v prospech očkovania proti COVIDu-19 u starších ľudí a pacientov s vekom súvisiacimi alebo inými základnými ochoreniami, pochopenie molekulárno-bunkovej podstaty AE vyvolaných vakcínou anti-SARS-CoV-2 mRNA je rozhodujúce pre prebiehajúce a budúce očkovacie a posilňovacie kampane. Súčasne by sa v dobre navrhnutých klinických skúškach mala rozvíjať prospektívna farmakovigilancia a dlhodobé monitorovanie (klinické/biochemické) očkovaných príjemcov v porovnaní so zodpovedajúcimi kontrolami. Okrem toho použitie alternatívnych chemických látok pre LNP a proteínu S v jeho uzavretej forme (nie náchylnej na väzbu ACE2) [126.] spolu s použitím nukleokapsidového proteínu SARS-CoV-2 alebo výlučne RDB S môžu byť cennými alternatívami pre zdokonalené mRNA vakcíny novej generácie. Nakoniec, keďže v podstate nevieme, ako dlho a v akej koncentrácii LNP a antigén(y) zostávajú v ľudských tkanivách alebo v obehu u ľudí so slabou odpoveďou na vakcínu, starších ľudí alebo detí, a vzhľadom na skutočnosť, že bunková imunita pravdepodobne pretrváva napriek zníženým neutralizačným titrom in vitro [28.], posilňujúce dávky by sa mali podávať len v prípade, že je jasne stanovený pomer prínosu a rizika.
Celkovo možno povedať, že súbežne s prebiehajúcim výskumom najnáročnejších tém týkajúcich sa biológie SARS-CoV-2, dynamiky vývoja a schopnosti adaptácie na ľudský druh (t.j. miera prenosu – infekcie a závažnosť ochorenia) by sa mal urýchliť základný a klinický výskum (pozri Nevyriešené otázky) zameraný na pochopenie molekulárno-bunkovej podstaty zriedkavých nežiaducich účinkov existujúcich mRNA vakcín prvej generácie ako naliehavej a životne dôležitej priority verejného zdravia.
Kútik pre klinických lekárov
Vzhľadom na množstvo existujúcich údajov o dostupných mRNA vakcínach je hlavným "známym" faktom, že v krátkodobom horizonte sú mRNA vakcíny príjemcom dobre tolerované a že môžu vyvolať silnú imunitnú odpoveď, a teda poskytnúť dlhodobú ochranu proti závažným prejavom COVID-19 (vrátane nových variantov vzbudzujúcich obavy); očkovanie tak zostáva hlavným nástrojom na zmiernenie pandémie COVIDu-19 a záchranu tisícov životov. Je dobre známe, že riziko závažnej formy COVIDu-19 sa zvyšuje s vekom alebo už existujúcimi komorbiditami. Vzhľadom na "neznáme", o ktorých sa tu hovorí, by sa mali zvyšujúce dávky u zdravých detí a dokonca aj u dospievajúcich podávať len vtedy, ak je jasne stanovený pomer prínosu a rizika. Multidisciplinárny klinický a základný výskum zameraný na pochopenie bunkovo-molekulárnej podstaty nežiaducich účinkov vyvolaných mRNA vakcínou proti COVIDu-19 – spolu s aktívnym farmakovigilančným systémom a dlhodobým zaznamenávaním hlásených nežiaducich účinkov v klinickom prostredí u očkovaných príjemcov – sú rozhodujúcimi zložkami na zlepšenie vakcín, zaručenie bezpečnosti, zachovanie dôvery a usmerňovanie zdravotnej politiky. Technológia mRNA vakcín sa bude naďalej vyvíjať, pretože otvára úplne novú éru nových aplikácií na rozsiahly vývoj nových vakcín proti rôznym infekčným a iným chorobám vrátane rakoviny.
Nevyriešené otázky
Aký je spôsob lokalizácie, účinnosť transfekcie a klírens mRNA vakcín LNP v ľudskom tele? Môžeme zdokonaliť chémiu LNP smerom k zachovaniu účinnosti transfekcie a zároveň zabezpečiť distribúciu v tkanivách na požiadanie? Súvisia nežiaduce zápalové reakcie zaznamenané po očkovaní – a ak áno, do akej miery – aj s LNP a/alebo mRNA použitými v mRNA vakcínach? Aké sú mechanistické podrobnosti expresie antigénu, spracovania a bunkovej lokalizácie po transfekcii buniek pomocou LNP? Aký vplyv by malo nadmerné "zdobenie" neprofesionálnych antigén-prezentujúcich transfekovaných ľudských (napr. pečeňových) buniek transmembránovým proteínom S? Uniká antigén alebo príbuzné podjednotky – peptidové fragmenty do obehu, a ak áno, v akej forme, v akej koncentrácii a ako dlho? Existuje nejaká súvislosť s imunitnými reakciami sprostredkovanými vakcínou? Je pravdepodobná väzba antigénu na ACE2 vo vaskulatúre zodpovedná za kardiovaskulárne, metabolické alebo iné (napr. súvisiace so zápalom) hlásené nežiaduce účinky? Prechádza antigén cez hematoencefalickú bariéru? Existuje nejaká pozoruhodná molekulárna mimikry (najmä hlavných antigénnych miest) medzi proteínom S a ľudským proteómom? Aký je profil slizničnej imunity vyvolanej mRNA vakcínami COVID-19? Je to tak, že imunita sprostredkovaná očkovaním (dve dávky) proti použitému ancestrálnemu antigénu (proteín S Wuhan-Hu-1) časom slabne, alebo jednoducho čiastočne strácame ochranu v dôsledku evolučných skokov proteínu S (napr. pri variante Omicron)? V takom prípade naozaj potrebujeme posilňovacie dávky s tým istým antigénom? Podporuje zvyšovanie dávok okrem zvyšovania titra protilátok aj diverzifikáciu protilátok? Aký by bol profil imunitných reakcií a AE po expresii proteínu S riadenej mRNA v jeho uzavretej forme (forma, ktorá nie je náchylná na väzbu ACE2)?
Slovník
Syndróm akútnej respiračnej tiesne (ARDS) je život ohrozujúci stav, pri ktorom sa v pľúcach hromadí tekutina, ktorá narúša funkciu výmeny plynov a zabraňuje okysličovaniu krvi a orgánov.
Nežiaduci účinok (AE) lieku alebo klinickej intervencie s potenciálne škodlivými následkami.
Angiotenzín konvertujúci enzým 2 (ACE2) – enzým, ktorý sa podieľa na homeostatickej regulácii hladín cirkulujúceho angiotenzínu I a angiotenzínu II ich premenou na peptidy angiotenzínu (1-9), resp. angiotenzínu (1-7).
Bellova obrna – idiopatická epizóda slabosti alebo ochrnutia tvárových svalov na jednej strane tváre. Tento stav je dôsledkom dysfunkcie siedmeho lebečného nervu (tvárového nervu).
Trombóza mozgových žíl – zriedkavá udalosť zrážania krvi, ktorá sa vyskytuje v žilových dutinách mozgu a zabraňuje odtoku krvi z mozgu. V dôsledku toho sa vytvára tlak, ktorý môže viesť k opuchu a krvácaniu.
Cytokínová búrka – charakteristika COVID-19 (alebo iného ochorenia), pri ktorej sa produkujú abnormálne vysoké hladiny cirkulujúcich cytokínov a prispievajú k závažnosti ochorenia.
Guillain-Barrého syndróm – zriedkavé autoimunitné neurologické ochorenie, pri ktorom imunitný systém organizmu chybne napáda periférne nervy, čo spôsobuje svalovú slabosť a v prípade neliečenia aj ochrnutie.
Dlhý COVID-19 – termín, ktorý označuje celý rad nových, vracajúcich sa alebo pretrvávajúcich príznakov, ktoré pretrvávajú aj po skončení počiatočnej fázy infekcie SARS-CoV-2.
Molekulárna mimikry – proces, pri ktorom je imunitná odpoveď proti cudziemu antigénu neúmyselne namierená aj proti vlastnému antigénu, ktorý sa veľmi podobá spúšťajúcemu cudziemu antigénu.
Receptorová väzbová doména (RBD) – časť väzobného proteínu (napr. v proteíne S SARS-CoV-2), ktorá slúži na ukotvenie proteínu k jeho receptoru.
Renín-angiotenzínový systém (RAS) – systém, ktorý má rozhodujúci význam pre fyziologickú reguláciu (okrem iného) nervových, črevných, kardiovaskulárnych funkcií, krvného tlaku a obličiek, ako aj rovnováhy tekutín a solí. Zahŕňa enzým renín, ktorý katalyzuje produkciu angiotenzínu I.
Sérologická analýza – akákoľvek analýza vykonávaná s krvným sérom, zvyčajne zameraná na meranie hladiny protilátok.
Syncytium – bunka s viacerými jadrami, ktorá vznikla viacnásobným splynutím jednojadrových buniek.
Virémia – detekcia vírusových častíc schopných replikácie v krvnom obehu.