Rýchle zvýšenie 25(OH)D v sére posilňuje imunitný systém proti infekciám, sepse a COVIDu-19
Nutrients 2022, 14(14), 2997; 21. júla 2022; https://doi.org/10.3390/nu14142997
(Tento článok patrí do osobitného vydania Potenciálna úloha vitamínu D pri COVIDe-19 a iných nových vírusových infekciách)
Abstrakt
Nedostatok vitamínu D je globálnym problémom verejného zdravia, pandémiou, ktorá bežne postihuje starších ľudí a ľudí s komorbiditami, ako sú obezita, cukrovka, hypertenzia, respiračné poruchy, opakujúce sa infekcie, imunitná nedostatočnosť a malignity, ako aj etnické menšiny žijúce v krajinách s miernym podnebím. Tie isté skupiny boli najviac postihnuté COVID-19. Keďže nedostatok vitamínu D oslabuje imunitný systém, zvyšuje riziko infekcií, komplikácií a úmrtí, napríklad na sepsu a COVID-19. Nedostatok sa dá nákladovo efektívne odstrániť cieleným obohacovaním potravín, doplnkovou výživou a/alebo každodenným bezpečným vystavovaním sa slnečnému žiareniu. Jeho endokrinné funkcie sú obmedzené na metabolizmus minerálov, muskuloskeletálny systém, špecifické interakcie bunkových membrán a funkcie prištítnych teliesok. S výnimkou rýchlych, endokrinných a na bunkových membránach založených negenómových funkcií všetky ostatné biologické a fyziologické aktivity vitamínu D závisia od adekvátnej vnútrobunkovej syntézy 1,25(OH)2D (kalcitriolu) v periférnych cieľových bunkách prostredníctvom genómu. Kalcitriol sprostredkúva autokrinnú (intrakrinnú) a parakrinnú signalizáciu v imunitných bunkách, ktorá zabezpečuje širšie ochranné imunitné funkcie rozhodujúce pre prekonávanie infekcií. Syntéza 1,25(OH)2D (kalcitriolu) v periférnych cieľových bunkách závisí od difúzie a endocytózy D3 a 25(OH)D z cirkulácie do nich, čo si vyžaduje udržiavanie sérovej koncentrácie 25(OH)D nad 50 ng/ml. Preto je pri akútnych infekciách, ako je sepsa a respiračné infekcie, napríklad COVID-19, potrebné rýchlo zabezpečiť jeho prekurzory, D3 a 25(OH)D, prostredníctvom cirkulácie, aby sa vytvoril dostatočný intracelulárny kalcitriol. Imunitná obrana je jednou z rozhodujúcich nehormonálnych funkcií vitamínu D. Jednorazová perorálna (bolusová) dávka alebo rozdelené úvodné dávky v rozmedzí 100 000 až 500 000 IU s použitím 50 000 IU vitamínu D3 zvyšujú sérové koncentrácie 25(OH)D na terapeutickú úroveň nad 50 ng/ml, ktorá trvá dva až tri mesiace. Zvýšenie sérového 25(OH)D trvá tri až päť dní. Naproti tomu jednorazová perorálna dávka kalcifediolu (0,014 mg/kg telesnej hmotnosti) môže vytvoriť potrebnú koncentráciu 25(OH)D do štyroch hodín. Vzhľadom na to, že D3 aj 25(OH)D vstupujú do imunitných buniek na tvorbu kalcitriolu, použitie kombinácie D3 (strednodobá) a kalcifediolu (okamžitá) je nákladovo efektívne a vedie k najlepším klinickým výsledkom. Na maximalizáciu ochrany pred infekciami, najmä na zníženie počtu komplikácií a úmrtí súvisiacich s COVID-19, by mali zdravotnícki pracovníci pacientom odporučiť bezpečné vystavovanie sa slnečnému žiareniu, primeranú suplementáciu vitamínom D a vyváženú stravu obsahujúcu zinok, horčík a ďalšie mikroživiny na podporu imunitného systému. Medzitým by mali vlády, Svetová zdravotnícka organizácia, Centrá pre kontrolu chorôb a vlády zvážiť podobné odporúčania pre lekárov a verejnosť, zmeniť zastarané odporúčania týkajúce sa vitamínu D a ďalších mikroživín určené pre ich obyvateľstvo a zorganizovať cielené programy fortifikácie potravín pre zraniteľné skupiny. Tento článok sa zaoberá racionálnym prístupom k udržiavaniu trvalej koncentrácie 25(OH)D v sére nad 50 ng/ml, ktorá je potrebná na dosiahnutie silného imunitného systému na prekonávanie infekcií. To by nákladovo efektívne zlepšilo zdravotný stav obyvateľstva a znížilo náklady na zdravotnú starostlivosť. Opisujú sa v ňom aj tri nákladovo efektívne a jednoduché protokoly na dosiahnutie a udržanie terapeutickej koncentrácie 25(OH)D v sére nad 50 ng/ml (> 125 nmol/l), aby sa udržalo zdravie obyvateľstva, znížila absencia, zlepšila produktivita a znížili náklady na zdravotnú starostlivosť.
1. Úvod
Endokrinné funkcie vitamínu D zahŕňajú muskuloskeletálny systém, pôsobenie membránových interakcií medzi vitamínom D a mediáciou a funkcie prištítnych teliesok závislé od vitamínu D, metabolizmus vápnika a fosfátov vrátane mineralizácie skeletu a absorpcie vápnika v gastrointestinálnom trakte a obličkových tubuloch. Naopak, signalizácia a funkcie periférnych cieľových buniek závisia od difúzie dostatočného množstva prekurzorov kalcitriolu – vitamínu D3 a 25(OH)D z cirkulácie do imunitných buniek. Väčšina funkcií periférnych cieľových buniek závislých od vitamínu D vrátane intrakrinnej/autokrinnej a parakrinnej signalizácie je podmienená dostatočnou vnútrobunkovou tvorbou kalcitriolu z 25(OH)D prostredníctvom jeho 1α-hydroxylácie.
Nízke cirkulujúce koncentrácie D3 a 25(OH)D bránia ich vstupu do imunitných buniek, a tým aj tvorbe kalcitriolu. Preto nedostatok vitamínu D (t.j. nízka hladina vitamínu D a 25(OH)D v cirkulácii) zhoršuje priaznivé účinky vitamínu D z periférnych cieľových buniek, napríklad funkcie imunitných buniek. V dôsledku toho hypovitaminóza D zvyšuje náchylnosť na infekcie a zhoršuje chronické ochorenia a závažnosť chorôb, čo vedie k vyššiemu počtu komplikácií a predčasných úmrtí. Napriek tomu, že doplnky vitamínu D sú bežne dostupné a ekonomicky výhodné na používanie a slnečné žiarenie je dostupné na celom svete, nedostatok vitamínu D je veľmi rozšírený. Chronický nedostatok vitamínu D výrazne zvyšuje zlý zdravotný stav, znižuje produktivitu a zvyšuje náklady na zdravotnú starostlivosť [1,2].
Niekedy počas roka je viac ako polovica svetovej populácie vystavená nedostatku vitamínu D, čím sa zvyšuje jej zraniteľnosť voči infekciám a zhoršujú sa chronické ochorenia [2]. Keďže D-hypovitaminóza je spojená s nežiaducimi účinkami, ktoré ovplyvňujú viaceré systémy, odhadli sme, že sa podieľa na štvrtine celkových nákladov na zdravotnú starostlivosť. Naopak, dostatok vitamínu D v populácii zlepšuje celkový zdravotný stav jednotlivcov a populácie a výrazne znižuje náklady na zdravotnú starostlivosť. V menšinových etnických skupinách a zraniteľných skupinách obyvateľstva možno stav vitamínu D zlepšiť cielenou a primeranou fortifikáciou základných potravín cholekalciferolom (D3) (a ďalšími mikroživinami).
Avšak typické dávky odporúčané pre ľudí a fortifikáciu potravín vládami, ich pridruženými subjektmi a lekárskymi spoločnosťami sú príliš malé na to, aby sa zabezpečilo dostatočné doplnenie populácie [1,3]. U dospelých ľudí s hmotnosťou 70 kg, ktorí prijímajú dávky vitamínu D3 vo výške 5000 IU/deň (0,125 mg/deň), by sa mohla dosiahnuť rovnovážna hodnota sérového 25(OH)D nad 50 ng/ml, ale bude to trvať niekoľko mesiacov [4,5]. Preto je v naliehavých prípadoch neúčinný. Toto oneskorenie sa však dá skrátiť na niekoľko dní podaním väčšej úvodnej dávky alebo jednej mg čiastočne aktivovaného vitamínu D, kalcifediolu [25(OH)D], ako je opísané nižšie [6].
Keďže väčšina ľudí na celom svete má niekedy počas roka nedostatok vitamínu D a tí, ktorí majú hypovitaminózu D, majú vyššie riziko infekcií, v núdzových situáciách a pri akútnom zhoršení chronických ochorení, môže predbežná dávka vitamínu D účinne a rýchlo zvýšiť sérové koncentrácie 25(OH)D. Veľmi vysoké dávky vitamínu D sa pod vedením odborníkov úspešne používajú pri stavoch, ako sú migréna a klastrové bolesti hlavy, psoriáza a autoimunitné ochorenia, ako je skleróza multiplex, reumatoidná artritída, zápalové ochorenia čriev, poruchy spojivového tkaniva atď. [4,6]. Tieto ochorenia sa rozoberajú ďalej v časti 4.2.
1.1. Hormonálne účinky metabolizmu kalcitriolu a vitamínu D
Hormonálna forma kalcitriolu sa vytvára v proximálnych renálnych tubulárnych bunkách renálnou 1α-hydroxylázou (CYP27B1), ktorá hydroxyluje 25(OH)D na najviac bioaktívnu formu, 1,25(OH)2D (kalcitriol), a transportom cez cirkuláciu viazanú na proteín viažuci vitamín D (VDBP). Táto premena je prísne regulovaná tromi hormónmi – 1α,25(OH)2D, FGF23, parathormónom (PTH) a ionizovaným vápnikom. Expresia mRNA CYP27B1 v obličkách je regulovaná PTH a aktivovaná prostredníctvom systému adenylcyklázy.
Prostredníctvom priameho (genómového) a nepriameho (negenómového) pôsobenia (podrobnosti sú uvedené v časti 1.3) inhibuje cirkulujúci kalcitriol syntézu parathormónu (PTH) v hlavných bunkách prištítnych teliesok. Kalcitriolom sprostredkovaná zvýšená absorpcia vápnika v čreve a z toho vyplývajúce zvýšené množstvo cirkulujúceho ionizovaného vápnika nepriamo znižuje sekréciu PTH. Zatiaľ čo kalcitriol je negatívnym regulátorom PTH – transkripcia génu PTH (ktorá trvá niekoľko hodín) a výsledný PTH stimuluje syntézu kalcitriolu v obličkových bunkách. Táto cirkulujúca, hormonálna forma kalcitriolu je nevyhnutná pre udržiavanie homeostázy vápnika a fosfátov, fyziologické funkcie muskuloskeletálneho systému, funkcie prištítnych teliesok a negenetické interakcie buniek s membránami [7].
Metabolizmus vitamínu D je regulovaný PTH a fibroblastovým rastovým faktorom-23 (FGF-23), ktoré úzko regulujú homeostázu vápnika a fosfátu. Prištítne telieska vylučujú PTH v reakcii na koncentráciu ionizovaného vápnika prostredníctvom receptorov vnímajúcich vápnik (homeostáza vápnika). Nízky kalcitriol stimuluje expresiu CYP27B1 a zvyšuje intracelulárny kalcitriol v obličkových bunkách. Zatiaľ čo vysoké koncentrácie cirkulujúceho kalcitriolu spôsobujú negatívnu spätnú väzbu [8]. Expresia CYP27B1 v obličkách je riadená PTH a FGF23 [1]. Tento systém je teda zložito prepojený.
1.2. Biologické rozdiely: Hormonálna forma v krvi vs. koncentrácia kalcitriolu v cieľovom tkanive a génová regulácia
Receptory vitamínu D/kalcitriolu (CTR, nazývané aj VDR) a enzým CYP27B1 sú hojne zastúpené v bunkách periférnych cieľových tkanív vrátane imunitných a cievnych buniek, ktoré hydroxylujú 25(OH)D na 1,25(OH)2D [9,10]. Vytvorenie dostatočného množstva intracelulárneho kalcitriolu v bunkách cieľového tkaniva si však vyžaduje udržiavanie sérových koncentrácií 25(OH)D nad 50 ng/ml. Pod touto hodnotou sú funkcie imunitného systému suboptimálne. V systéme spätnej väzby sú aktívne metabolity vitamínu D inaktivované cytochrómovými enzýmami, 24,25-hydroxylázou (CYP24A1) a CYP3A4.
Keď sa v týchto bunkách vytvorí dostatočné množstvo kalcitriolu, interaguje s CTR a premiestni komplex do jadra. V jadre sa komplex 1,25(OH)2D-CTR heterodimerizuje s receptorom retinoidu-X (RXR). Tieto komplexy sa viažu na prvky odpovede na vitamín D (VDRE) na cieľových génoch a regrutujú transkripčné faktory, korepresory a koaktivátory, ktoré modulujú transkripciu DNA. Interakcie receptorového komplexu s väzbovými doménami DNA iniciujú transkripciu génov, čo vedie k regulácii viac ako tisíc génov [11]. Rôzne tkanivá však majú rôzne prahové hodnoty 25(OH)D v sére pre správnu funkciu [12]. Napríklad koncentrácia 25(OH)D v sére 20 ng/ml je dostatočná na premenu obličkových tubulárnych buniek na hormonálny kalcitriol pre funkcie pohybového aparátu [10,12,13,14].
Zatiaľ čo kontrola rastu rakovinových buniek, autoimunity, uľahčenie autokrinnej/intrakrinnej a parakrinnej signalizácie a silná imunitná odpoveď si vyžadujú dlhodobejšie udržiavanie cirkulujúcich koncentrácií 25(OH)D nad 50 ng/ml [8,15,16]. Okrem toho sú takéto koncentrácie 25(OH)D v sére potrebné na prekonanie infekcií a kontrolu viacerých chronických porúch [12]. Ako je opísané v ďalšej časti, 25(OH)D a 1,25(OH)2D sprostredkúvajú aj rýchle negenetické účinky, ktoré sú nevyhnutné pre niektoré fyziologické deje vrátane endocytotického vstupu prekurzorov do buniek, integrity tesných spojov v epiteliálnych a endotelových bunkách a imunitných reakcií [9]. Rozoberá mechanizmy zapojené do rýchlych netranskripčných funkcií vitamínu D (kalcifediolu a kalcitriolu), ktoré pôsobia prostredníctvom membránových receptorov.
1.3. Negenomické účinky vitamínu D
Rýchle pôsobenie steroidných hormónov vrátane kalcitriolu sa uskutočňuje prostredníctvom membránovo asociovaných CTR a proteíndisulfidizomerázy, člena 3 (Pdia3) receptorovej rodiny [8]. Tento systém by sa mal považovať za súčasť endokrinného systému vitamínu D. Takéto mechanizmy sú prítomné aj pri iných steroidných hormónoch [1]. Zatiaľ čo biologické účinky konvenčných (kanonických) genomických účinkov steroidných hormónov vrátane kalcitriolu trvajú hodiny až dni, prejavujúce sa membránové negenomické účinky kalcitriolu a kalcifediolu trvajú len minúty.
Okrem toho netranskripčné účinky nie sú ovplyvnené inhibítormi transkripcie alebo syntézy proteínov [2]. Tým sa vysvetľuje nezapojenie genomických mechanizmov rýchleho pôsobenia steroidných hormónov rozpustných v lipidoch [3]. Kubilínom sprostredkovaná endocytóza vitamínu D je ďalším príkladom rýchleho pôsobenia vitamínu D spojeného s membránovým receptorom vitamínu D. V článku Donata a kol. z roku 2022 sa opisuje niekoľko negenomických rýchlych pôsobení vitamínu D [17,18,19].
Endotelovej nestabilite a cievnym únikom spojeným s niektorými ochoreniami vrátane infekcií zabraňuje suplementácia D3 alebo jeho aktívnych metabolitov. Údaje naznačujú, že negenómové pôsobenie D3 je rozhodujúcou zložkou pri sprostredkovaní stability epitelových a endotelových buniek nezávisle od bežných kanonických transkripčných dráh súvisiacich s vitamínom D [9]. Vitamín D a jeho dva bežné metabolity, 25(OH)D a 1,25(OH)2D, majú podobnú silu týchto rýchlych účinkov. V dôsledku toho nedostatok D3 oslabuje túto ochrannú epitelovú bariéru, spôsobuje vaskulárnu dysfunkciu, únik tekutín a šírenie infekcií [9], čo vedie k sepse [10]. D3 sprostredkované neenómové, netranskripčné mechanizmy teda uľahčujú potláčanie infekcií a zápalu a zabraňujú destabilizácii endotelových a epitelových buniek. Poskytovanie aktívnych metabolitov, kalcifediolu alebo kalcitriolu, je na prekonanie nedostatočné.
V obličkových tkanivách získaných od osôb so zlyhaním obličiek sa uvádzajú negenetické účinky vitamínu D. Okrem užívania štandardnej substitučnej liečby kalcitriolom sa požitím vitamínu D3 (cholekalciferolu) a/alebo kalcifediolu) zlepšuje kvalita života a prežívanie osôb s CKD z akejkoľvek príčiny [4]. Ďalší príklad negenómových účinkov vitamínu D.
Nedostatok vitamínu D [t.j. nízka hladina vitamínu D a 25(OH)D v cirkulácii] zhoršuje priaznivé klinické výsledky vitamínu D napriek tomu, že v cirkulácii sú normálne koncentrácie kalcitriolu. Na rozdiel od D3 a 25(OH)D nepodlieha cirkulujúci kalcitriol endocytóze alebo internalizácii do periférnych cieľových buniek, ako sú imunitné bunky a bunky zapojené do metabolizmu. Hormonálna forma kalcitriolu v krvi teda nemá žiadnu hmatateľnú možnosť iniciovať genómovo sprostredkované výsledky v imunitných bunkách. V dôsledku toho hypovitaminóza D, ako je opísané vyššie, zvyšuje zraniteľnosť a závažnosť chronických ochorení a infekcií, čo vedie k vysokému výskytu komplikácií a predčasných úmrtí [5].
1.4. Význam podávania vitamínu D3 u osôb so zlyhaním obličiek
Vitamín D má pleiotropné účinky na telesné systémy, najmä na imunitný, kardiovaskulárny, neurologický a renálny systém. Pacienti s chronickým ochorením obličiek (CKD) majú nedostatok vitamínu D, 25(OH)D a 1,25(OH)2D. Je to spôsobené problémami, ako je gastrointestinálna malabsorpcia, zvýšený katabolizmus a porucha 1α-hydroxylácie v obličkách. Tá je čiastočne spôsobená hyperfosfatémiou a zvýšenou hladinou fibroblastového rastového faktora-23 (FGF-23), ktorý negatívne kontroluje produkciu kalcitriolu v renálnych tubulárnych bunkách [6].
Abnormality metabolizmu vitamínu D vedú k sekundárnej hyperparatyreóze a strate kostnej hmoty, ktorá reaguje na podávanie kalcitriolu [4]. Podávanie rodičovského vitamínu D3 v kombinácii s kalcitriolom však u týchto pacientov výrazne zvýšilo kvalitu života a prežívanie. Ako bolo opísané vyššie, zvýšená expresia CYP24A1 zvyšuje klírens vitamínu D a jeho aktívnych metabolitov. Tým sa zvyšuje pomer sérového "24,25-dihydroxyvitamínu D ku kalcifediolu plus kalcitriolu" (známy ako katabolický pomer vitamínu D). Vyššie pomery sú spojené so zvýšenou úmrtnosťou zo všetkých príčin [7].
1.5. Zdôvodnenie potreby univerzálnej minimálnej koncentrácie 25(OH)D v sére
Na základe mnohých publikácií základného a klinického výskumu sme odhadli, že približne 75% funkcií imunitného systému človeka závisí od udržiavania zdravej, fyziologickej koncentrácie 25(OH)D v sére. Kumulatívne údaje za posledné desaťročie potvrdzujú, že požadovaná minimálna koncentrácia 25(OH)D v sére pre funkcie imunitného systému je 50 ng/ml [20,21,22,23]. Viaceré súbory údajov potvrdili potrebu takejto univerzálnej minimálnej koncentrácie 25(OH)D podporujúcej celkové zdravie a pohodu ľudí. Na základe mnohých overených vedeckých údajov autor obhajuje, aby sa 50 ng/ml stalo dolnou hranicou nového globálneho štandardu pre "dostatok vitamínu D", ktorý pokrýva približne 98% zdravotných porúch postihujúcich ľudí.
Viaceré publikované odporúčané minimálne koncentrácie 25(OH)D v sére špecifické pre jednotlivé orgány alebo ochorenia sú mätúce [3,12,14]. Preto je užitočné mať univerzálne použiteľnú minimálnu sérovú koncentráciu 25(OH)D, ktorá dokáže prekonať ochorenia súvisiace s nedostatkom vitamínu D. Univerzálna minimálna požadovaná koncentrácia 25(OH)D v sére 50 ng/ml je bezpečná a účinná s terapeutickým rozsahom od 50 do 80 ng/ml. Udržiavanie takýchto hladín si nevyžaduje pravidelné monitorovanie sérových koncentrácií 25(OH)D ani nevedie k nežiaducim účinkom [24]. Je to najlepšia obrana pri prevencii chorôb, najmä infekcií, minimalizácii porúch imunity, ako sú autoimunitné poruchy, rakovina, a pri znižovaní komplikácií.
2. Koncentrácie vitamínu D v sére 25(OH)D potrebné na prekonanie infekcií
Pravidelné slnenie môže zvýšiť koncentrácie vitamínu D3 a 25(OH)D v krvnom obehu nad 30 ng/ml. Avšak moderný životný štýl, oblečenie, migrácia obyvateľstva mimo slnečných klimatických podmienok, prevažne interiérový spôsob života a čoraz častejšie správanie vyhýbajúce sa slnku bránia jeho dosiahnutiu. Okrem niektorých tučných rýb ulovených vo voľnej prírode, húb vystavených slnku a obohatených potravín je obsah vitamínu D zo zdrojov stravy zanedbateľný. Ani strava, ani vitamín D v multivitamínových tabletách nedokážu kompenzovať nedostatok primeraného denného vystavenia sa slnečnému žiareniu [25]. Preto by sa človek nemal spoliehať na získavanie dostatočného množstva vitamínu D prostredníctvom multivitamínových tabliet, kým nie sú zahrnuté správne dávky. Aj pri príležitostnom vystavovaní sa slnku a užívaní multivitamínových doplnkov je ťažké dosiahnuť a udržať koncentráciu 25(OH)D v sére nad 50 ng/ml bez doplnkov.
2.1. Nedostatok vitamínu D oslabuje imunitnú obranu proti infekciám
Nedostatočné vystavenie ultrafialovému žiareniu (UVB) je hlavnou príčinou celosvetovej pandémie D-hypovitaminózy [1]. Vyhýbanie sa slnečnému žiareniu a nadmerné používanie opaľovacích krémov tento problém ešte zhoršujú [2,8,25,26]. Z uvedených dôvodov je nepravdepodobné, že aj samotné pravidelné vystavovanie sa slnečnému žiareniu vytvorí dostatočné koncentrácie cirkulujúceho D3 a 25(OH)D, ktoré sú potrebné na silnú imunitnú odpoveď. V dôsledku toho mnohí potrebujú na udržanie zdravia doplnky vitamínu D. Prevalencia hypovitaminózy D je najvyššia v zimnom období. Okrem toho dva roky prerušovaných neopodstatnených lockdownov počas nedávnej pandémie COVID výrazne zvýšili chudobu a súvisiacu podvýživu, zhoršili celosvetový nedostatok vitamínu D a zvýšili chorobnosť a úmrtnosť.
Uvedené lockdowny spojené s nečinnosťou, zneužívaním alkoholu a obezitou prispeli k zvýšenému výskytu nedostatku vitamínu D. Uzávery a zákaz vychádzania znížili priemernú koncentráciu 25(OH)D v sére, čím výrazne zvýšili nezraniteľnosť voči vírusu SARS-CoV-2, jeho komplikáciám a úmrtiam [26,27]. Stav výživy je jedným z rozhodujúcich aspektov zodpovedných za celkové zdravie a pohodu vrátane udržiavania správneho fungovania imunitného systému [17,28]. Okrem vitamínu D sú na optimalizáciu funkcií endokrinného systému potrebné aj ďalšie základné mikroživiny, ako napríklad zinok, horčík, omega-3 mastné kyseliny, kvercetín atď. Zinok a horčík sú tiež potrebné pre správnu biologickú aktivitu kalcitriolu, jeho receptorov a imunitného systému [27,29,30,31]. Ich nedostatočný príjem zhoršuje klinické výsledky D-hypovitaminózy.
2.2. Prekážky podávania opakovaných/cyklických vysokých dávok vitamínu D
Napriek výhodám niektoré štúdie uvádzajú, že značné opakované bolusové dávky vitamínu D nedosahujú ciele, ako je prevencia rachitídy [10]; a dokonca môžu zvyšovať počet pádov. Suboptimálne klinické výsledky sa môžu vyskytnúť sekundárne v dôsledku špičiek (t.j. výrazného kolísania) sérových koncentrácií 25(OH)D. Medzi mechanizmy patrí zníženie regulácie tvorby kalcitriolu obličkami a regulácia enzýmu 24-hydroxylázy (CYP24A1) [32,33].
K nezvýšeniu sérového 25(OH)D môže dôjsť aj v dôsledku gastrointestinálnej malabsorpcie alebo suboptimálnej hepatálnej hydroxylácie. Neexistujú však žiadne dôkazy o tom, že jednorazová dávka vitamínu D3 až do 500000 IU, ktorá znižuje reguláciu CYP27B1, bráni premene 25(OH)D na kalcitriol alebo zvyšuje expresiu CYP24A1 v imunitných bunkách [34,35], alebo o iných známych nežiaducich účinkoch [22,36,37].
Vzhľadom na kratší polčas rozpadu však pri podávaní vysokých bolusových dávok vitamínu D s odstupom viac ako troch týždňov (17 dní alebo viac) dochádza k výrazným výkyvom koncentrácií 25(OH)D a 1,25(OH)2D v krvnom obehu a v bunkách cieľového tkaniva. Táto neschopnosť stabilizovať a udržať koncentrácie v krvi a v cieľovom tkanive (napr. v prostate) a nadmerná expresia 24-hydroxylázy znižujú koncentrácie 25(OH)D a kalcitriolu v sére, čím sa znižujú ich biologické funkcie. Preto by zriedkavé podávanie vitamínu D nemalo byť dlhšie ako 17 dní: z praktických dôvodov by nemalo byť častejšie ako každé dva týždne.
Uvedené zvyšuje katabolizmus kalcitriolu a znižuje jeho endokrinnú produkciu v obličkových tubulárnych bunkách [38]. Nemusí však nevyhnutne zhoršiť syntézu kalcitriolu v bunkách periférnych cieľových tkanív. Napriek tomu sa hydroxylácia 25(OH)D na 1,25(OH)2D v periférnych cieľových tkanivách/bunkách, ako sú bunky imunitného systému, zníži, ak interval podávania vitamínu D presiahne dva týždne alebo sa podáva nedostatočná dávka vitamínu D. Platí pravidlo, že čím dlhší je interval medzi jednotlivými dávkami, tým je priaznivá biologická aktivita menšia. Táto nestálosť cirkulujúcich koncentrácií 25(OH)D a 1,25(OH)2D by mohla aktivovať katabolické cesty metabolizmu vitamínu D. Následne môže zhoršiť klinické výsledky, počnúc muskuloskeletálnymi dysfunkciami a rozšírením na iné tkanivá pri závažnom nedostatku vitamínu D.
Nie vyššie sérové koncentrácie 25(OH)D ako také, ale výrazné kolísanie metabolitov vitamínu D v krvnom obehu a v tkanivách spôsobuje nepriaznivé klinické výsledky po opakovaných bolusových dávkach vitamínu D. Mnohé súbory údajov potvrdili, že udržiavanie sérových koncentrácií 25(OH)D nad 40 ng ml výrazne znižuje komorbidity [38]. Na prekonanie infekcií a prevenciu komplikácií, prevenciu rakoviny a zníženie mortality zo všetkých príčin je však potrebné udržiavať cirkulačné koncentrácie 25(OH)D vyššie ako 50 ng/ml.
2.3. Kalcitriol alebo jeho analógy by sa nemali používať ako doplnky vitamínu D
Zatiaľ čo cirkulačný polčas kalcifediolu je dva až tri týždne [39], kalcitriol vydrží len niekoľko hodín [40]. Nadbytok alebo špičky kalcitriolu v krvi zastavujú expresiu a sekréciu PTH a zvyšujú spätnú expresiu enzýmu 24-hydroxylázy (CYP24A1), ktorý katabolizuje kalcifediol a kalcitriol na ich neaktívne 24-hydroxylované metabolické produkty [41,42]. Podobne sa tento mechanizmus spätnej väzby aktivuje opakovanými vysokými (bolusovými) dávkami vitamínu D; preto by sa mu malo predchádzať.
Na rozdiel od vitamínu D3 a 25(OH)D je terapeutické okno (t. j. ED 50) pre kalcitriol úzke. Dávka kalcitriolu potrebná na to, aby 50% populácie dosiahlo 50% požadovanej odpovede (t.j. aby bola 50% účinná), je blízka jeho toxickej dávke. V dôsledku toho má podávanie kalcitriolu značné riziko nežiaducich účinkov, ako je hyperkalciémia a hyperkalciúria, downregulácia CYP2R1 prostredníctvom zvýšenej produkcie FGF23 a upregulácia tkanivového enzýmu katabolizmu vitamínu D-24-hydroxylázy.
Keďže exogénny kalcitriol nevstupuje do imunitných buniek [43], nie je dôvod na podávanie kalcitriolu v akejkoľvek dávke na posilnenie imunitného systému alebo ako doplnkovej liečby infekcií [10]. Podávanie kalcitriolu nemá prínos pri kontrole infekcií, zvyšuje riziko významných nežiaducich účinkov. Výnimkou sú osoby s hypoparatyreózou a pokročilým zlyhaním obličiek. Preto neprekvapuje zlyhanie klinických výsledkov pri použití kalcitriolu vo viacerých nedávno publikovaných randomizovaných kontrolovaných klinických štúdiách (RCT) na osobách so sepsou a COVID-19. Zlyhania výsledkov boli predvídateľné v dôsledku použitia nesprávneho lieku (nebol lepší ako placebo) a chybného dizajnu štúdie [41,42].
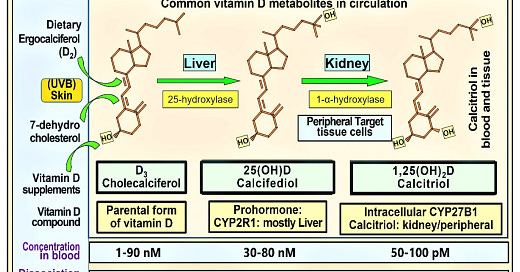
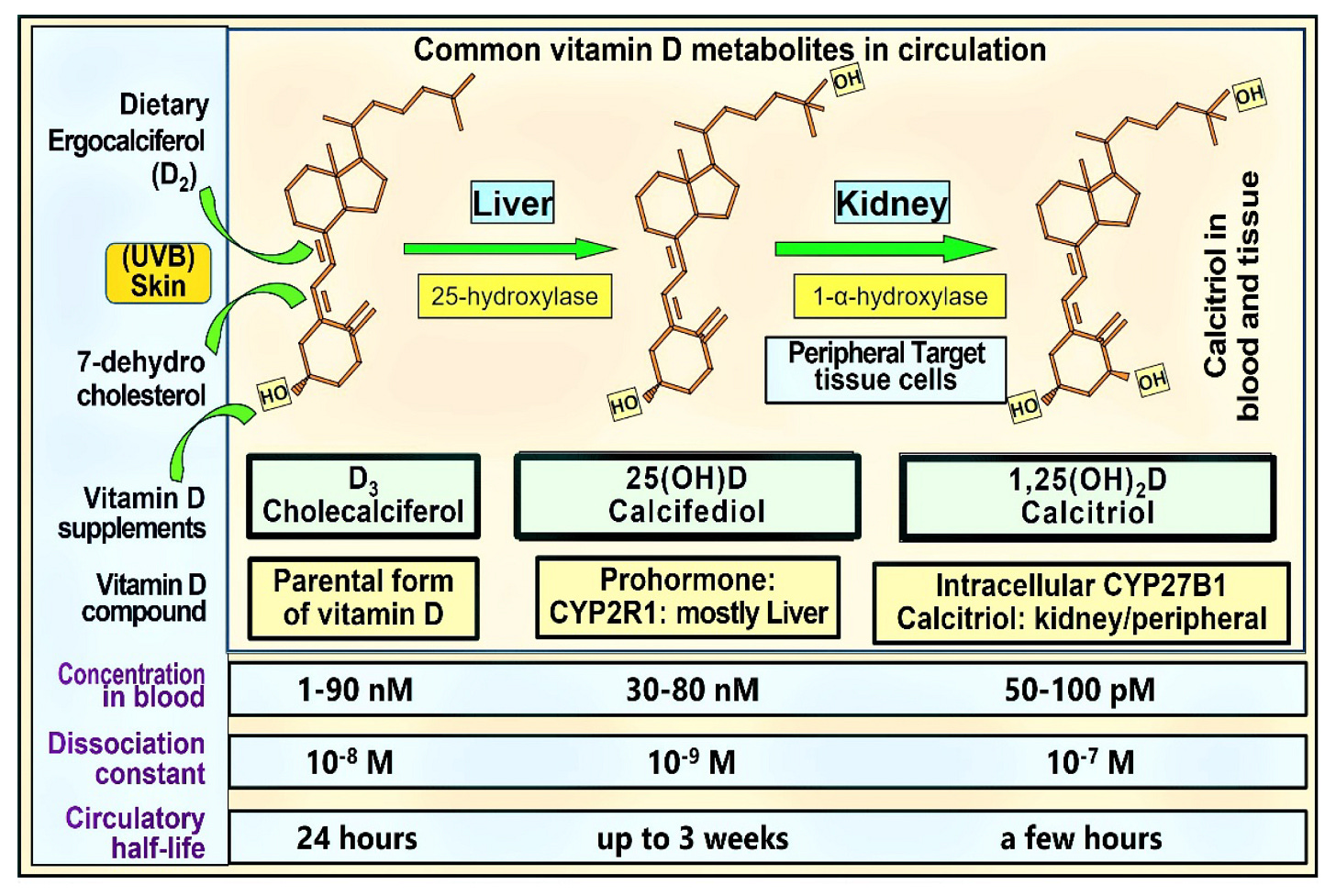
Vzhľadom na premrštené náklady, nedostatočnú absorpciu imunitnými bunkami a negatívne spätnoväzbové mechanizmy znižujúce reguláciu by sa kalcitriol ani jeho 1α-analógy nemali používať ako doplnky vitamínu D alebo liečba infekcií vrátane COVID-19. Obrázok 1 znázorňuje štruktúru a funkcie bežne používaných analógov vitamínu D: cirkulačné hladiny, disociačné konštanty a cirkulačné polčasy.
obrázok 1. Obrázok znázorňuje štruktúry troch najznámejších, klinicky relevantných analógov vitamínu D, ich primárne miesta tvorby in situ, príslušné hydroxylačné enzýmy a uvádzané koncentrácie v krvnom obehu. Zatiaľ čo u ľudí sa cirkulačné hladiny D3 a 25(OH)D3 vyskytujú v nanomolárnom rozsahu, 1,25(OH)2D je v pikomolárnom rozsahu: približne tisíckrát menšia koncentrácia (číselné údaje od Hollisa a kol. doplnené v posledných dvoch riadkoch, [9]).
Kalcitriol má z troch najbežnejších metabolitov vitamínu D najvyššie percento voľných (neviazaných alebo voľne viazaných na VDBP) zložiek v obehu. Keďže však koncentrácia kalcitriolu je približne tisíckrát nižšia ako D3 a 25(OH)D, jeho absolútne voľné množstvo je veľmi nízke a nepostačuje na vstup do imunitných buniek. Hoci je 25(OH)D prítomný v podobných koncentráciách v obehu, je pevnejšie viazaný na VDBP ako vitamín D3. Preto je kvantitatívne a percentuálne pri dennom užívaní vzhľadom na jeho relatívne nižšiu afinitu k VDBP k dispozícii viac D3 na difúziu/endocytózu do cieľových buniek v porovnaní s 25(OH)D [9]. To poukazuje na dôležitosť dostupnosti D3 ako prekurzora na tvorbu kalcitriolu v periférnych cieľových bunkách. Tento prínos sa však stráca, ak sa nevhodne spoliehame na 25(OH)D alebo 1,25(OH)2D a ignorujeme príjem rodičovského D3. V dôsledku toho by sa kalcifediol napriek svojim krátkodobým výhodám nemal rutinne používať ako doplnok vitamínu D.
Difúzne koeficienty (vrátane endocytózy) týchto troch zlúčenín prechádzajú do cieľových buniek a korelujú s ich cirkulujúcimi koncentráciami, polčasmi a afinitou k VDBP. Na ich základe si možno predstaviť, že do periférnych cieľových buniek sa dostáva približne rovnaké množstvo D3 a 25(OH)D. Tieto dve zložky sa však môžu navzájom kompenzovať.
Okrem toho, ako bolo opísané vyššie, bunky obličkových tubulov, svalového a tukového tkaniva majú zabudovaný aktívny transportný mechanizmus na vstup D3 a 25(OH)D do buniek – megalin-kubilínový endocytotický receptorový systém [11]. Tento endocytotický systém má zásadný význam pri dodávaní vitamínu D a 25(OH)D nielen do ich centrálneho cieľa, proximálnych renálnych tubulárnych buniek v obličkách, ale aj do náčelníckych buniek prištítnych teliesok pre ich endokrinné funkcie prostredníctvom 1α-hydroxylácie [11]. Tieto molekuly využívajú podobný mechanizmus na vstup do svalových a tukových buniek [12].
2.4. Prínosy zvýšenia dostatku vitamínu D v populácii počas pandémie
Bol zaznamenaný inverzný vzťah medzi sérovou koncentráciou 25(OH)D pred pandémiou a 50% znížením rizika COVID-19 u 190 tisíc dospelých Američanov v päťdesiatich štátoch [44]. V tejto skupine dospelých riziko infekcie a komplikácií významne a nepriamo súvisí so stavom vitamínu D pred pandémiou [15,45]. Iné štúdie uvádzajú vzťahy medzi sérovou koncentráciou 25(OH)D a znížením rizika infekcie.
Dlhodobé doplnenie vitamínu D prostredníctvom suplementácie je nákladovo najefektívnejším a najpraktickejším prístupom na udržanie silnej imunity populácie, zníženie záťaže chorobami a nákladov na zdravotnú starostlivosť [20,46]. Čím vyššia imunita populácie sa dosiahne udržiavaním vyššej koncentrácie 25(OH)D v sére, tým nižšie sú riziká symptomatických infekcií a komplikácií pri epidémiách a pandémiách, ako je COVID-19, a to aj bez očkovania. To je jedno z vysvetlení nižšej miery komplikácií, hospitalizácie a úmrtí, ktoré sa zaznamenali v krajinách s menším počtom očkovaných proti COVID.
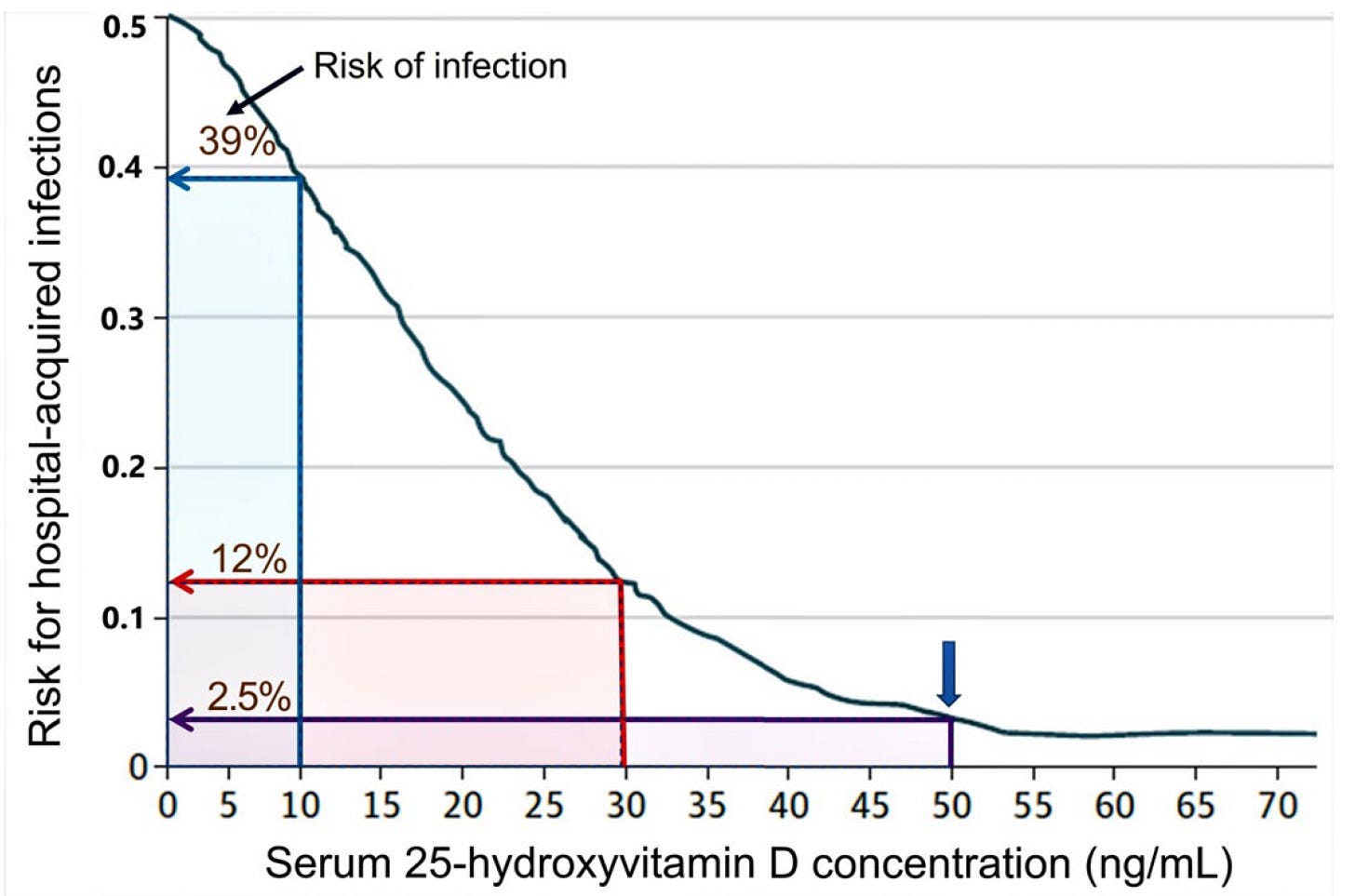
Príklad silnej súvislosti medzi koncentráciou 25(OH)D v sére a infekciami je znázornený na obrázku 2. Táto prospektívna klinická štúdia hodnotila vzťah medzi koncentráciou 25(OH)D v sére a rizikom výskytu nemocničných infekcií. Táto klinická štúdia tiež poukázala na dôležitosť udržiavania sérovej koncentrácie 25(OH)D nad 50 ng/ml na zníženie miery infekcií na úroveň pozadia [15,20].
obrázok 2. Inverzný vzťah medzi stavom vitamínu D a rizikom nemocničných infekcií. Maximálne zníženie miery infekcií sa dosiahlo, keď koncentrácia 25(OH)D v sére presiahla 50 ng/ml (t. j. miera pozadia). To podporuje, že 50 ng/ml ako minimálna hladina potrebná na prekonanie infekcií. Údaje prezentované ako multivariabilná logistická regresná analýza s lokálne váženým rozptylom. Na preukázanie rozdielov v riziku hospitalizácie sú znázornené percentuálne riziká infekcií pri sérových koncentráciách 25(OH)D 10, 30 a 50 ng/ml. Modrá šípka znázorňuje základné riziko približne 2,5 % (upravené podľa Quraishi, S.A, et al., 2014) [15].
3. Vitamín D a imunitné funkcie
Nízka sérová koncentrácia 25(OH)D pri prijatí do nemocnice predpovedá závažnosť a úmrtia na COVID-19 [44,45,47,48,49,50]. Nízky stav vitamínu D pred pandémiou je v závislosti od dávky a nepriamo spojený s vyšším rizikom ochorenia na COVID-19 a jeho závažnosťou [44,45]. Význam dostatku vitamínu D na adaptívnu imunitu ilustruje zvýšená tvorba protilátok v sére v závislosti od 25(OH) D po imunizácii proti COVID [47,48].
3.1. Úloha vitamínu D v imunitnej ochrane proti infekciám
Existovala príležitosť strategicky využiť kombináciu imunitnej ochrany odvodenej od širšej a dlhšie trvajúcej prirodzenej imunity po infekcii s imunitou odvodenou po očkovaní (úzkou a krátkodobou) na obmedzenie šírenia, komplikácií a úmrtí na SARS-CoV-2 a na eradikáciu vírusu. Svetové orgány však takýto praktický prístup ignorovali. Namiesto toho sa WHO a CDC z dôvodu prebiehajúcich globálnych politických trendov rozhodli odporúčať a úplne sa spoliehať na vakcíny COVID, pričom ignorovali hodnotu prirodzenej imunity. To zabránilo dosiahnutiu kolektívnej imunity a eradikácii SARS-CoV-2.
Nové celosvetové údaje ukazujú neustálu stratu účinnosti napriek zvyšujúcemu sa počtu posilňovacích dávok vakcín COVID-19. Strata účinnosti vakcín COVID je čiastočne spôsobená rozvojom imunitnej tolerancie a zvýšeným počtom mutácií, najmä v oblasti Spike proteínu vírusu SARS-CoV-2, čo viedlo k vyhýbaniu sa imunitnému systému [51,52]. To súvisí aj so zvýšenou mierou komplikácií v dôsledku reakcií na antigén medzi očkovanými [53] (prístup 4. mája 2022). Vakcíny COVID na báze mRNA síce znižujú závažnosť a komplikácie, ale špecifickosť neutralizačných protilátok je úzka a namierená len proti častiam Spike proteínu a nevytvára slizničnú imunitu. V dôsledku toho takéto vakcíny nezabraňujú šíreniu SARS-CoV-2 ani opätovnej infekcii.
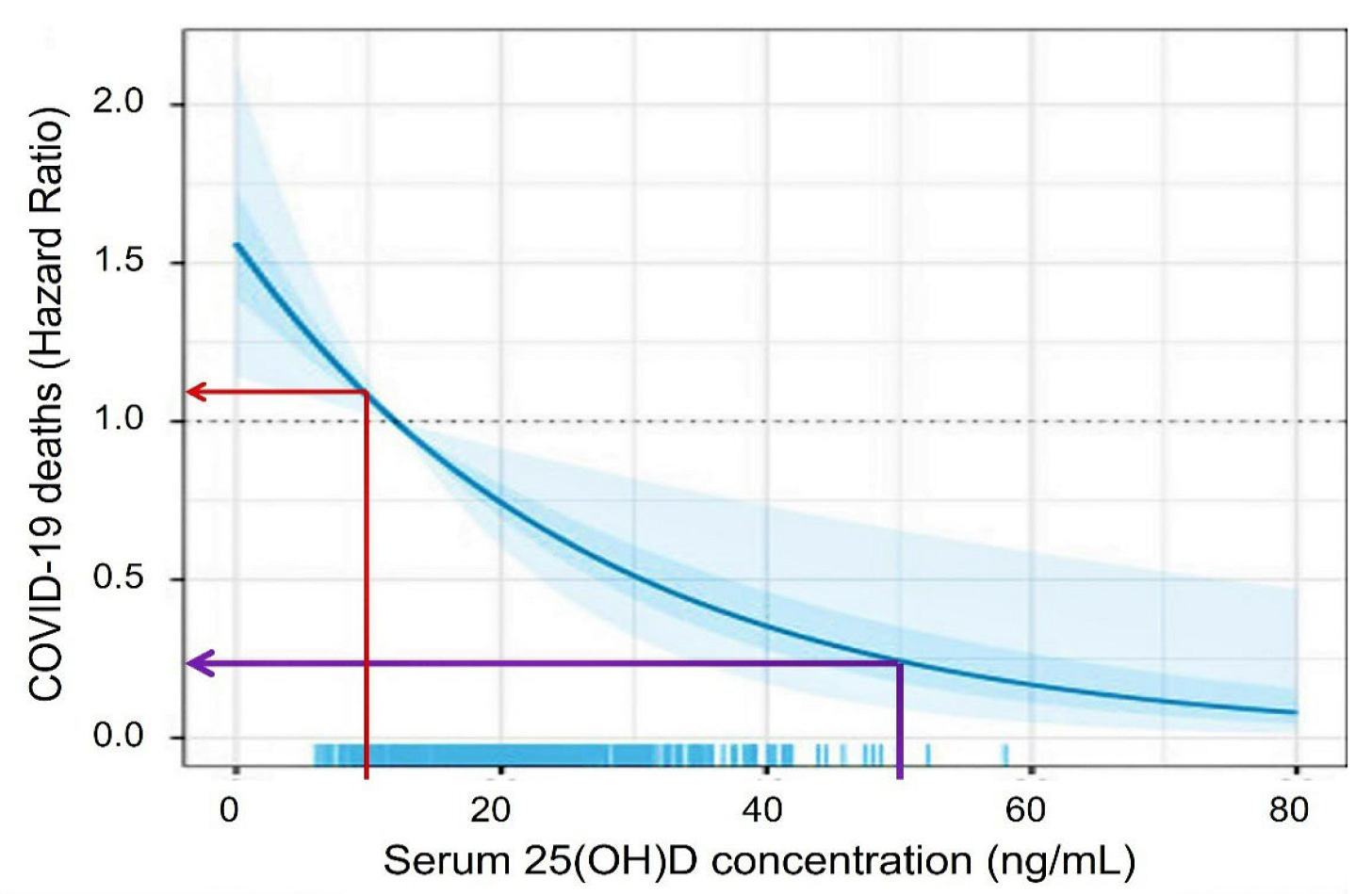
Dostatok vitamínu D zlepšuje imunitné funkcie [54]. Významne znižuje riziko vírusových a bakteriálnych infekcií dýchacích ciest [55,56,57] a znižuje riziko nežiaducich následkov COVID-19: vrátane úmrtnosti na SARS-CoV-2 [55] a komplikácií po imunizácii. Ako je znázornené na obrázku 3, úmrtnosť na COVID-19 je štvornásobne nižšia, ak má človek koncentráciu 25(OH)D v sére nad 50 ng/ml [55]. Jednorazová bolusová dávka vitamínu D alebo kalcifediolu, o ktorej sa hovorí vyššie, alebo úvodná dávka vitamínu D, o ktorej sa hovorí neskôr, môže rýchlo dosiahnuť spomínanú terapeutickú koncentráciu 25(OH)D v sére, a tým zlepšiť klinické výsledky. Metódy uvedené v časti 5 nižšie na rýchle dosiahnutie vyšších sérových koncentrácií 25(OH)D sú praktické a účinné pri odstraňovaní závažného nedostatku vitamínu D a posilňovaní imunitného systému. Sú užitočné v naliehavých prípadoch na dosiahnutie rýchleho zvýšenia koncentrácie 25(OH)D, ako v prípade COVID-19 [15,20,58,59,60].
obrázok 3. Simulácia postestimácie koncentrácií 25(OH)D s použitím 15 a 50 ng/ml ako hraničných hodnôt predpovedá viac ako štvornásobne vyššiu úmrtnosť z COVID-19. Údaje upravené podľa veku, pohlavia, BMI, C-reaktívneho proteínu, D-diméru, saturácie kyslíkom a chronických ochorení, ako je diabetes 2. typu a chronické ochorenie obličiek (upravené podľa Vanegas-Cedillo, P. et al., 2022) [55].
3.2. Biologicky dostupný D3 a 25(OH)D pre vnútrobunkovú syntézu kalcitriolu v cieľových bunkách
Trvalá koncentrácia 25(OH)D v sére nad 50 ng/ml [20] je rozhodujúca pre udržanie robustných vrodených a adaptívnych reakcií, ktoré zabraňujú imunitnej dysregulácii a hyperzápalovým reakciám. Čiastočné klinické potvrdenie tejto skutočnosti je znázornené na obrázkoch 2 a 3 [20,61,62,63]. Vzhľadom na technické a praktické ťažkosti pri meraní intracelulárnych metabolitov vitamínu D (napr. v imunitných bunkách) za fyziologických podmienok nie je známa biologická citlivosť ani hraničné hodnoty.
VDBP a ďalšie väzbové proteíny sa syntetizujú v pečeni a sú regulované glukokortikoidmi, estrogénmi a zápalovými cytokínmi. Z cirkulujúceho 25(OH)D tvorí biologicky dostupný 25(OH)D (voľný plus viazaný na VDBP) približne 15% celkového množstva. Táto časť je k dispozícii na vstup do periférnych cieľových buniek prostredníctvom koncentračného gradientu a endocytózy [41,64]. Biologicky dostupná zložka vitamínu D3 má nižšiu afinitu k VDBP ako 25(OH)D. Preto keď sú cirkulujúce koncentrácie D3 a 25(OH)D podobné, do imunitných buniek môže vstúpiť väčšie množstvo D3. Ako už bolo spomenuté, do obličiek, svalov a tukových tkanív sa vitamín D a 25(OH)D viazaný na VDBP dostáva aktívnym procesom, transportným komplexom megalín/kubilín prostredníctvom endocytózy [65]. Toto je ďalší príklad mechanizmu receptorovej membrány vitamínu D. Tento aktívny proces endocytózy je základným predpokladom syntézy hormonálnej formy kalcitriolu, 1,25(OH)2D [64].
Priame merania intracelulárnych koncentrácií metabolitov vitamínu D nie sú ani spoľahlivé, ani uskutočniteľné. Koncentrácia hormonálnej formy kalcitriolu v cirkulácii je približne 0,045 ng/ml. Koncentrácia kalcitriolu potrebná na intrakrinnú/autokrinnú a parakrinnú signalizáciu v imunitných bunkách sa však odhaduje na približne 1,0 ng/ml. To je o viac ako dva rády vyššie ako koncentrácia cirkulujúceho kalcitriolu. Preto je nepravdepodobné, že by cirkulujúci kalcitriol vstupoval do imunitných buniek proti takému vysokému gradientu.
3.3. Autokrinná a parakrinná signalizácia v imunitných bunkách
Na rozdiel od vstupu kalcitriolu do obličkových tubulárnych buniek si vstup vitamínu D a 25(OH)D do periférnych cieľových buniek, ako sú imunitné bunky, pre ich autokrinné/intrakrinné funkcie vyžaduje vyššiu cirkulujúcu koncentráciu týchto zlúčenín. Preto si periférne cieľové bunky vyžadujú vyšší gradient koncentrácie D3 a 25(OH)D v sére (t. j. nad 50 ng/ml) na vstup do imunitných buniek ako renálne tubulárne bunky. Neudržanie cirkulujúcich hladín vitamínu D v dôsledku periodickej nedostatočnosti koncentrácií D3 a 25(OH)D, sekundárne pri prerušovanom, opakovanom podávaní bolusových dávok vitamínu D v intervaloch dlhších ako dva týždne (alebo z iných dôvodov kolísania cirkulujúcich hladín) sa ukázalo ako neúčinné pre zamýšľané priaznivé účinky vitamínu D, ako sa ukázalo v niektorých nedávnych klinických štúdiách [13].
Protokoly opísané v tabuľke 1 a tabuľke 2 sú určené na jednorazové bolusové alebo nakladacie dávky na zvýšenie sérových hladín a imunitného systému; tieto nie sú určené na opakované podávanie [15]. Preto nepodlieha spomínaným výkyvom v cirkulačných hladinách, a teda sa vyhýba vyššie uvedeným nežiaducim účinkom. Vzhľadom na kratší polčas rozpadu vitamínu D v obehu je vhodnejšie podávanie denných alebo týždenných dávok. Napriek tomu je adherencia (compliance) k liečbe raz za týždeň podstatne lepšia ako denné alebo raz za dva týždne, pretože sa ľahko pamätá, podobne ako pri iných zriedkavo užívaných medikamentóznych liečbach, ako pri liečbe osteoporózy bisfosfonátmi raz za týždeň v porovnaní s denným príjmom. Pri začatí liečebného režimu by sa však mali zohľadniť preferencie pacienta a jeho cestovateľské zvyklosti, aby sa dosiahlo lepšie dodržiavanie liečby. Počas navrhovania protokolov štúdií RCT by sa mala zohľadniť očakávaná compliance, ktorá vytvára priaznivé klinické výsledky.
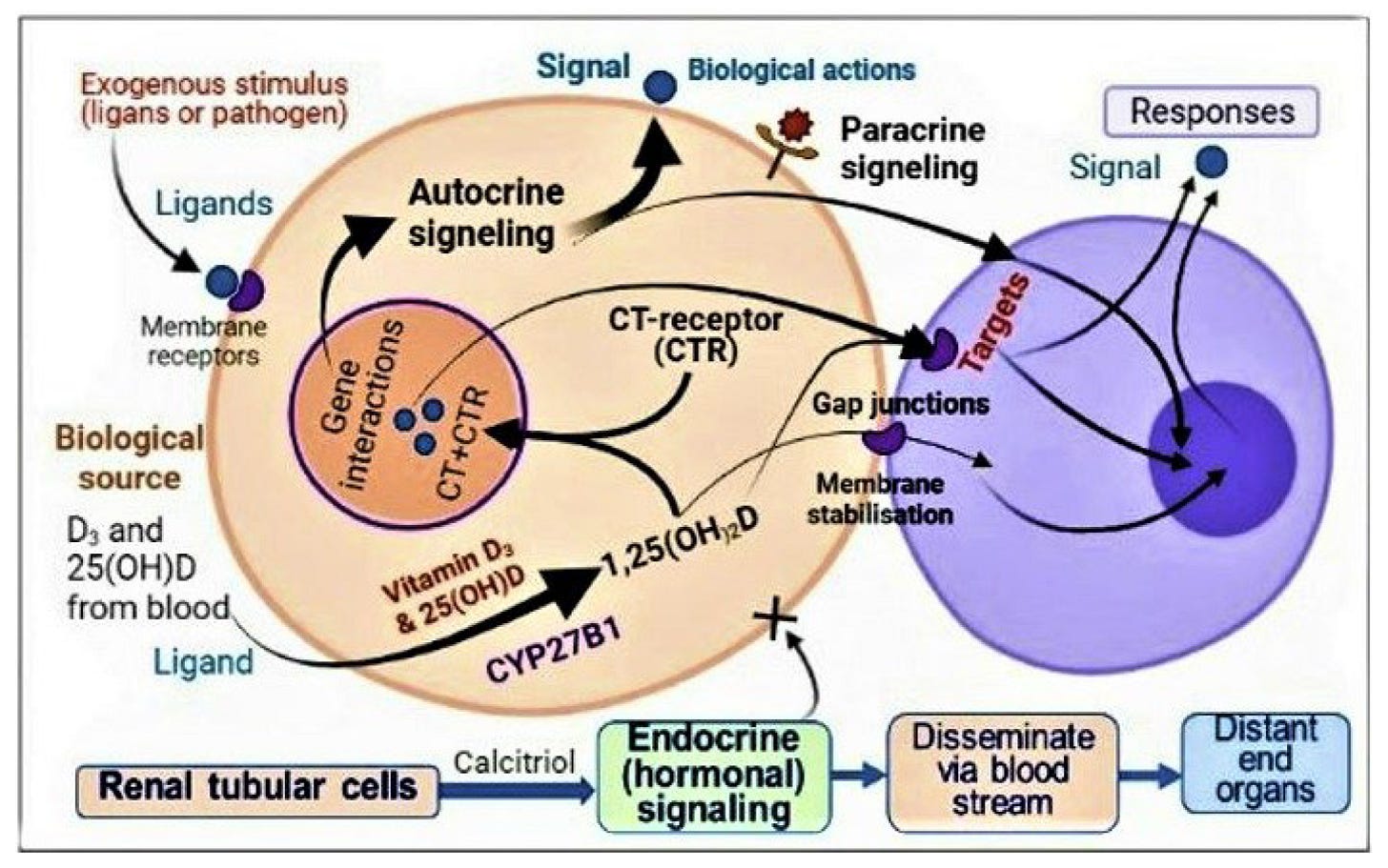
Okrem toho má väčšina ľudí na celom svete sérové koncentrácie 25(OH)D medzi 15 a 30 ng/ml (t.j. stav nedostatku vitamínu D), čo bráni dostatočnému množstvu D3 a 25(OH)D dostať sa do imunitných buniek [66,67]. Preto nie je prekvapujúce, že majú slabý imunitný systém. Preto je v akútnych situáciách, ako je sepsa a COVID-19, potrebné rýchlo zvýšiť sérový vitamín D3 aj 25(OH)D na dostatočnú koncentráciu, čo umožní týmto molekulám vstúpiť do imunitných a iných cieľových buniek a vytvoriť vnútrobunkový kalcitriol [62,63,68] (obrázok 4).
obrázok 4. Znázorňuje intracelulárnu tvorbu kalcitriolu v imunitných bunkách, ktoré aktivujú autokrinné a parakrinné signalizačné mechanizmy. Po vstupe vitamínu D a 25(OH)D do periférnych cieľových buniek (napr. imunitných buniek) pasívnou difúziou a/alebo aktívnou endocytózou ich CYP2R1 a CYP27B1 hydroxylujú za vzniku 1,25(OH)2D (kalcitriolu). Imunitné bunky obsahujú veľké množstvo CYP2R1, CYP27B1 a kalcitriolových receptorov (CTR). Komplexy kalcitriol-CTR vstupujú do jadra a interagujú s genómom, čím regulujú expresiu génov smerom nahor alebo nadol, ako je opísané v časti 1.2. To vedie k zvýšenej expresii antimikrobiálnych peptidov, protilátok atď. a znižuje expresiu zápalových a oxidačných cytokínov.
3.4. Zlepšenie stavu vitamínu D, zníženie rizika komplikácií COVID-19
Dostatok vitamínu D zvyšuje aktivitu vrodeného aj adaptívneho imunitného systému [56,57]. Viaceré klinické štúdie uvádzajú významný prínos suplementácie vitamínu D pri akútnych infekciách dýchacích ciest [24,69,70,71]. Viaceré RCT uvádzajú, že suplementácia vitamínom D posilňuje imunitné reakcie proti sezónnym/zimným vírusovým infekciám dýchacích ciest s 50% znížením výskytu a závažnosti [57,72,73].
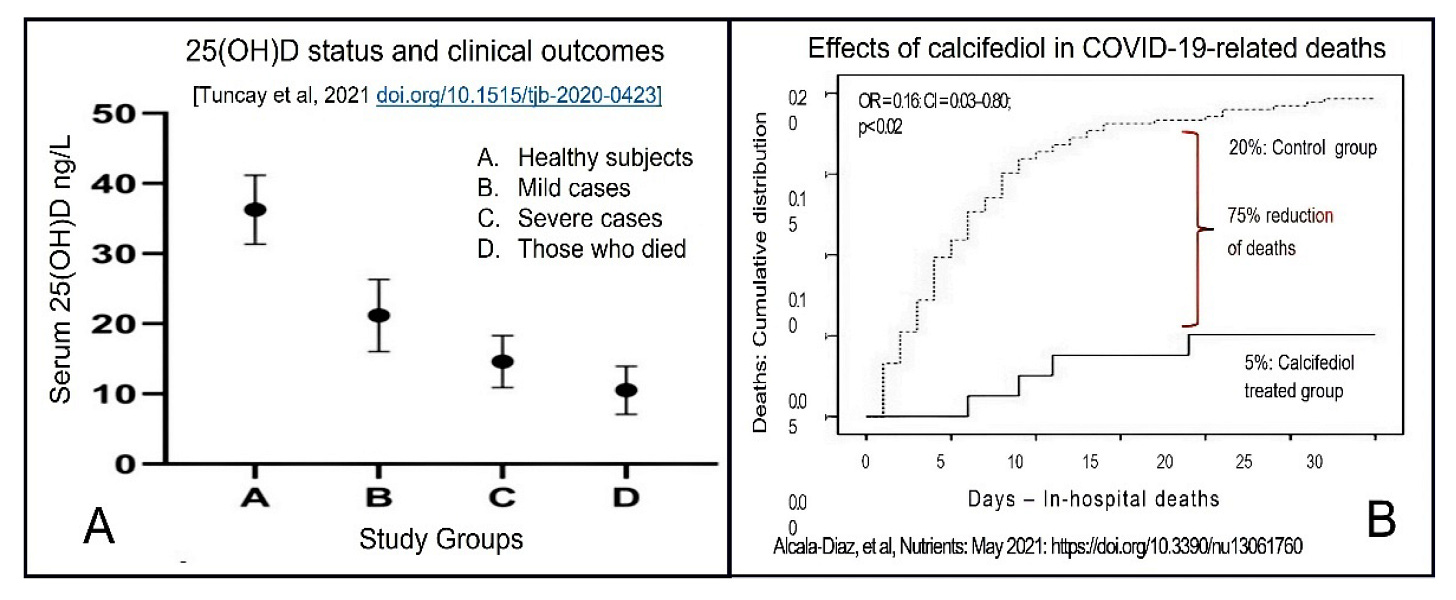
Mnohé štúdie uvádzajú silný inverzný vzťah medzi sérovou koncentráciou 25(OH)D a závažnosťou a úmrtnosťou na COVID-19 [74,75,76,77]. Čiastočne aktivovaný vitamín D, 25(OH)D (kalcifediol) podávaný perorálne, pôsobí do štyroch hodín od podania a je vhodný na použitie. Dávky od 0,5 do 1,0 mg dokážu zvýšiť sérovú koncentráciu 25(OH)D na terapeutickú (nad 50 ng/ml) do štyroch hodín namiesto niekoľkých dní ako pri bežnom, rodičovskom vitamíne D3 [78,79]. Takéto dávky kalcifediolu však nevyvolávajú downreguláciu produkcie kalcitriolu autoregulačnými mechanizmami [10]. Obrázok 5 znázorňuje vyššiu účinnosť (t.j. lepšie klinické výsledky – zníženie počtu úmrtí) údajov z RCT s použitím 0,523 mg kalcifediolu u osôb so stredne závažným COVID-19. Štúdia preukázala, že kalcifediol znížil úmrtnosť o 75% v porovnaní s kontrolnou skupinou [79,80].
obrázok 5. (A). Významná inverzná korelácia medzi sérovými koncentráciami 25(OH)D a závažnosťou a úmrtnosťou na COVID-19 (podľa Tuncay et al., 2021) [80]. (B). Kumulatívna nemocničná úmrtnosť osôb liečených kalcifediolom v porovnaní s kontrolnou skupinou. Úmrtnosť bola 5% v liečenej skupine oproti 20% v skupine s placebom: zníženie úmrtnosti o 75% v skupine liečenej kalcifediolom (podľa Alcala-Diaz, et al., 2021) [81].
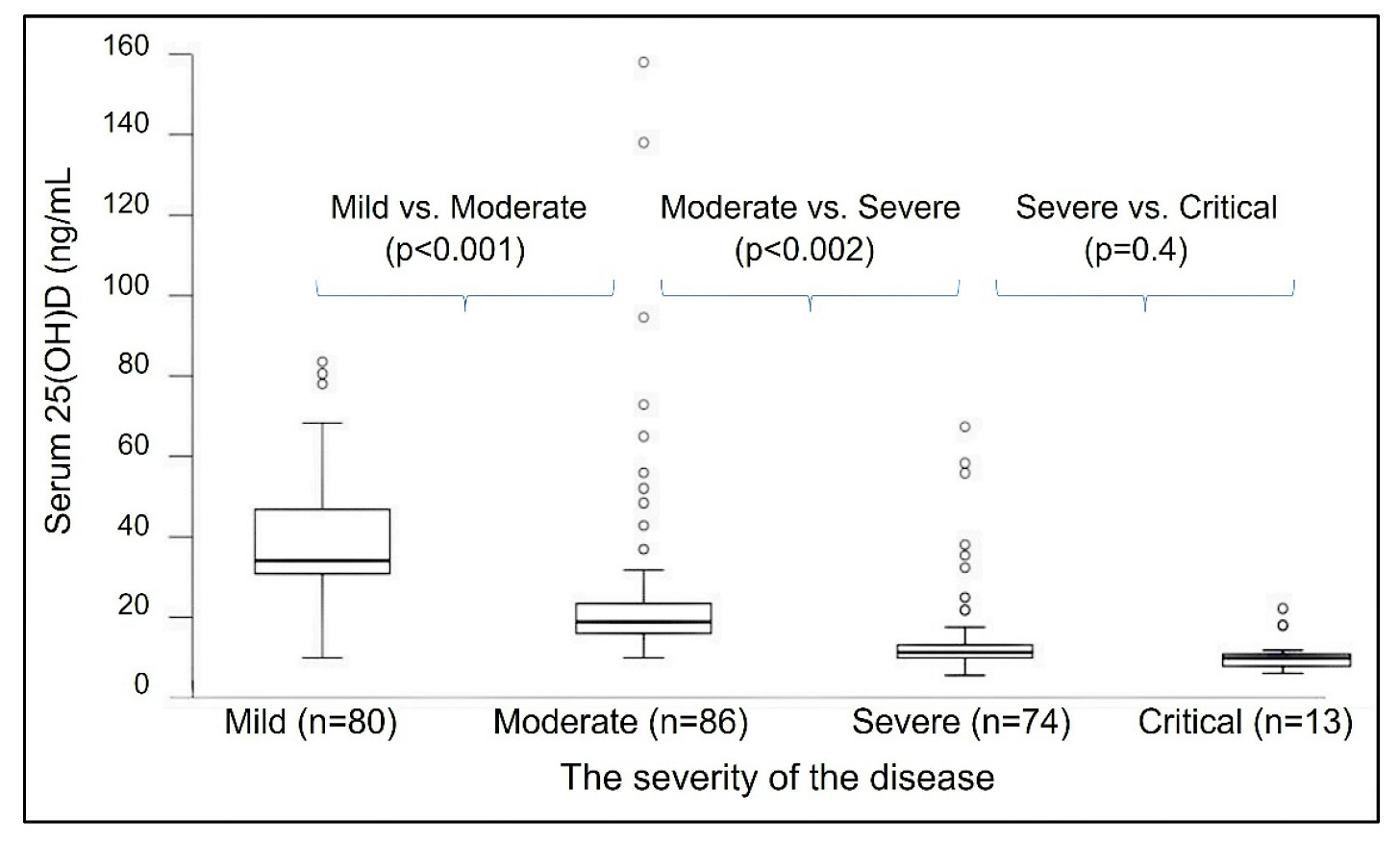
Iné štúdie uvádzajú, že minimálna koncentrácia 25(OH)D v sére potrebná pre lepší zdravotný stav nie je 30 ng/ml, ale 40 ng/ml [71,82,83]. Na optimálnu imunitnú odpoveď, prevenciu rakoviny a zníženie úmrtnosti zo všetkých príčin je však potrebná minimálna sérová koncentrácia 25(OH)D 50 ng/ml [84] (obrázok 2 a obrázok 3). Obrázok 6 znázorňuje inverzný vzťah medzi závažnosťou ochorenia spojeného s COVID-19 a sérovými koncentráciami 25(OH)D pred infekciou [45].
obrázok 6. Krabicové grafy [rozsah sérových koncentrácií 25(OH)D 50% prípadov, v rámci medzikvartilového rozpätia] naznačili významnú súvislosť medzi závažnosťou COVID-19 a sérovou koncentráciou 25(OH)D pred infekciou (n = 253). Porovnávali sa priemerné koncentrácie vitamínu 25(OH)D so štyrmi kategóriami závažnosti COVID-19 – od miernej po kriticky chorú, pričom sa použila definícia závažnosti WHO (WHO/2019-nCoV/klinická/2020.5). Hodnoty p sú uvedené po porovnaniach viacerých kategórií pomocou neparametrického Kruskal-Wallisovho testu. Mannov-Whitneyho U-testom sa porovnávali koncentrácie 25(OH)D s priemerným poradím susedných postupných kategórií a jednotlivé odľahlé hodnoty sú prezentované otvorenými krúžkami (podľa Drorl et al., 2022) [45].
4. Zhrnutie dôkazov z klinických sledovaní
Mnohé pozorovania a niektoré RCT preukázali silnú inverznú koreláciu medzi sérovými koncentráciami 25(OH)D a rizikami COVID-19 [44,45,84]: výskytom, závažnosťou, počtom hospitalizácií na JIS a úmrtnosťou [45,47,56,57,84,85,86]. Samotná suplementácia vitamínom D a v kombinácii s kalcifediolom významne znížila komplikácie [35,45,47,87], hospitalizácie a úmrtnosť [85,86]. Je pozoruhodné, že na rozdiel od vitamínu D3 kalcifediol potrebuje lekársky predpis a lekári zatiaľ nie sú oboznámení s jeho prínosom a spôsobom jeho používania.
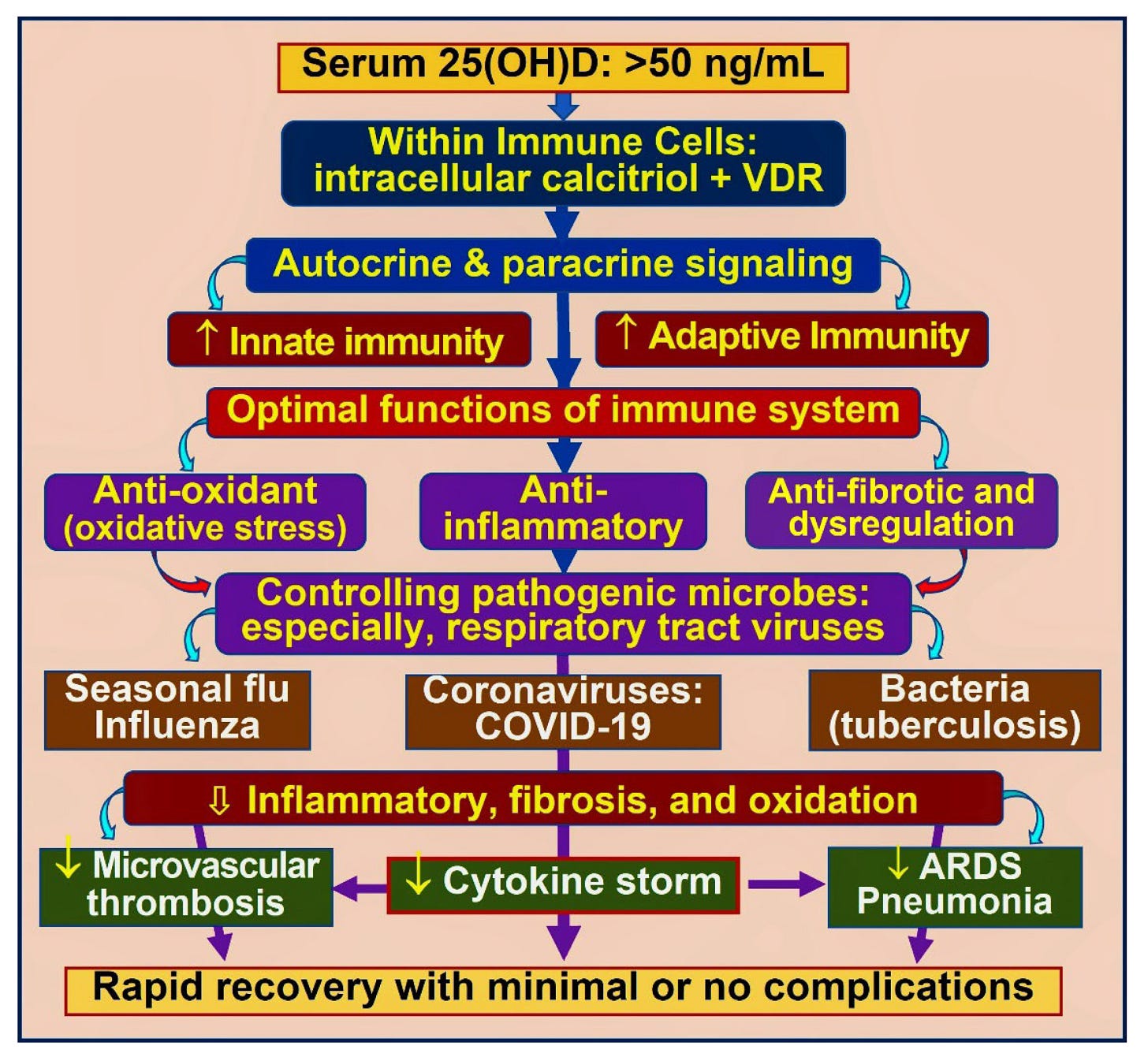
Väčšina ľudí, u ktorých sa vyvinul post-COVID syndróm, mala hypovitaminózu v čase nakazenia SARS-CoV-2 alebo hospitalizácie. Obrázok 7 znázorňuje komplexné interakcie vitamínu D pri modulácii vrodeného a adaptívneho imunitného systému. Vitamín D je tiež neuroprotektívny a minimalizuje výskyt a závažnosť dlhodobejších komplikácií, ako je napríklad post-COVID syndróm [19,88]. Mnohé RCT, v ktorých sa porovnával kalcifediol v porovnaní s kontrolami, preukázali významné zníženie komplikácií COVID-19, hospitalizácií a úmrtnosti [45,81,86,87]: v RCT Alcala Diax a kol. sa používal kalcifediol raz týždenne [81] (obrázok 5). Napriek týmto pozitívnym klinickým štúdiám neprekvapuje, že zle navrhnuté RCT hlásili zlyhanie výsledkov [89,90].
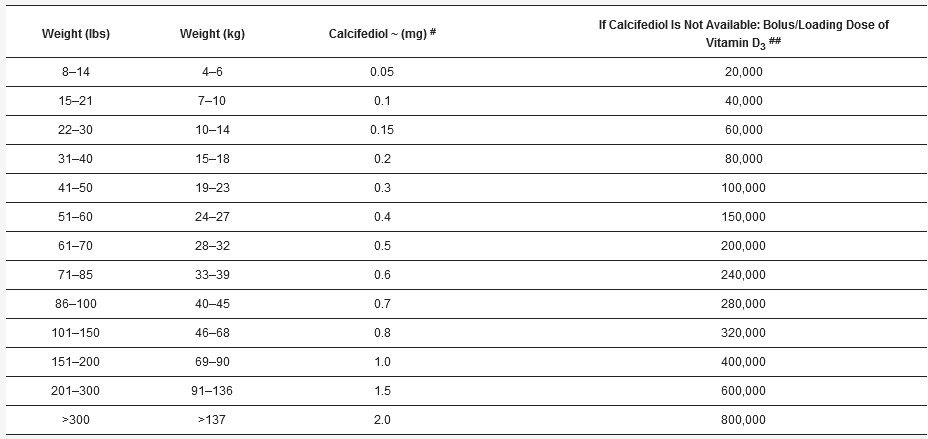
obrázok 7. Zvýšenie regulácie vrodených a adaptívnych imunitných funkcií imunitných buniek kalcitriolom. Príklady zahŕňajú protizápalový a antioxidačný prínos, downreguláciu vírusovej replikácie, zníženie rizika cytokínových búrok, mikrovaskulárnej trombózy a syndrómu akútnej respiračnej tiesne (ARDS).
Obrázok 7 tiež ilustruje dôležitosť udržiavania sérovej koncentrácie 25(OH)D nad 50 ng/ml pre správne fungovanie imunitných buniek a sprostredkovanie ich kľúčových autokrinných a parakrinných funkcií. Optimálne fungovanie alebo vrodené a adaptívne imunitné reakcie by zabránili cytokínovým búrkam a komplikáciám spôsobeným infekciami, čo by viedlo k rýchlemu zotaveniu z ochorenia. V nasledujúcej časti sa rozoberajú zriedkavé potenciálne komplikácie spôsobené nadbytkom vitamínu D.
4.1. Potenciálne nepriaznivé účinky vitamínu D prostredníctvom hyperkalciémie
V spoločnosti je hyperkalciémia najčastejšie spôsobená (väčšinou) nediagnostikovanou hyperparatyreózou. V nemocničnom prostredí však bežne súvisí s rakovinou v dôsledku neprimeranej sekrécie peptidu súvisiaceho s parathormónom (PTHrP) a metastatickým ochorením kostí [91,92]. Iné príčiny hyperkalciémie, ako napríklad genetické mutácie CYP24A1 atď. sú veľmi zriedkavé [93,94].
Pri zistení hyperkalciémie by sa malo podávanie vápnika a vitamínu D zastaviť a mala by sa vyšetriť hlavná príčina. Navrhované dávky vitamínu D v tabuľke 1 a tabuľke 2 nižšie sú bezpečné, pokiaľ počiatočné (východiskové) sérové koncentrácie 25(OH)D nepresahujú 60 ng/ml (ide o veľmi malú časť populácie), v súčasnosti neužívajú vysoké dávky, ako je 50 tisíc IU, častejšie ako raz za dva týždne alebo nemajú sporadické genetické poruchy [45,86,95,96,97,98]. Tieto kategórie ľudí majú pravdepodobne vyššie sérové koncentrácie 25(OH)D alebo môžu mať vyššiu citlivosť; preto nepotrebujú suplementáciu vitamínom D alebo vápnikom.
Treba však byť opatrný, keď sérové hladiny 25(OH)D prekročia 150 ng/ml [99]. Niekoľko štúdií zaznamenalo nežiaduce účinky zo zvýšenia cirkulujúceho ionizovaného vápnika v dôsledku zvýšenej gastrointestinálnej a renálnej absorpcie po extrémne vysokých sérových koncentráciách 25(OH)D (t.j. nad 200 ng/ml), ktoré sú spojené s vysokými sérovými koncentráciami 1,25(OH)2D. Tomu sa dá predísť zastavením užívania doplnkov vápnika a výrazným znížením príjmu vápnika v potrave, ako je to opísané v Coimbrovom protokole [37].
4.2. Terapeutické intervencie – odporúčanie pre vysoké dávky vitamínu D
Kapsuly s vyššími dávkami vitamínu D3 (spravidla 50000 IU; 60000 IU kapsuly v Indii) sú dostupné vo väčšine krajín za symbolickú cenu. Niekoľko štúdií uvádza, že konzumácia denných dávok vitamínu D3 20000 IU [100,101] až 50000 IU [98] je bez nežiaducich účinkov, ako je hyperkalciémia alebo hyperkalciúria, dokonca aj u detí [36]. Takéto dávky sa však neodporúčajú širokej verejnosti, pokiaľ ich nepredpísal odborník s odbornými znalosťami z konkrétneho dôvodu, ako je psoriáza alebo migréna. Ľudia, ktorí konzumujú takéto vysoké denné dávky, musia pracovať pod priamym dohľadom skúseného lekára s pravidelnými kontrolami krvi.
Napriek tomu sú vyššie dávky perorálneho vitamínu D indikované pri špecifických klinických stavoch, ako sú infekcie [45,86,95,96,97,98], vrátane COVID-19 [86] (pozri časť 5), ktorý poskytuje ohromujúci prínos. Ďalšie indikácie na predpisovanie vysokých dávok vitamínu D súvisia so špecifickými zdravotnými problémami, ktoré riadia príslušní odborníci. Príkladom sú poruchy rezistentné na vitamín D (napr. rachitída rezistentná na vitamín D; genetické abnormality enzýmov CYP), hypoparatyreóza, genetická a získaná hypofosfatemická osteomalácia, renálna osteodystrofia, migréna, psoriáza, malabsorpcia, obezita, osteomalácia sekundárne pri poruche funkcie pečene atď.
4.3. Nákladovo efektívne stratégie na udržanie silného imunitného systému prostredníctvom vitamínu D
Základnými opatreniami verejného zdravotníctva na prevenciu vírusových infekcií dýchacích ciest je nosenie masiek na tvár typu N95 alebo KN95, vyhýbanie sa uzavretým vnútorným priestorom a hromadným zhromaždeniam a dodržiavanie bezpečných vzdialeností medzi ľuďmi. Cieľom je zabrániť vstupu veľkého množstva vírusov do ľudských buniek a ich replikácii a minimalizovať virémiu. Kroky na zablokovanie výskytu symptomatického ochorenia sú prevencia alebo zabránenie vstupu vírusov cez receptory ACE-2 viazané na bunkovú membránu (vstupujú väčšinou cez dýchacie cesty), inhibícia vnútrobunkovej replikácie vírusov, neutralizácia a deštrukcia vírusov in vivo a zvýšená eliminácia vírusov z tela prostredníctvom silného imunitného systému.
Uvedené je možné dosiahnuť kombináciou (A) prirodzeného posilnenia imunitného systému zvýšením sérovej hladiny 25(OH)D u jednotlivca a populácie s cieľom predchádzať poruchám imunitného systému a prekonávať infekcie, (B) udržiavaním robustného imunitného systému v populácii pomocou vystavovania sa slnečnému žiareniu a dostatku vitamínu D, (C) ochranou zraniteľných - starších ľudí a ľudí s komorbiditami, (D) zhodnotením a využitím prirodzenej imunity tých, ktorí sa zotavili z COVID-19, a (E) miliardami ľudí imunizovaných vakcínami. Zdravotnícke orgány mohli spoločne využiť uvedené skutočnosti na praktickú cestu k dosiahnutiu kolektívnej imunity zameranej na eradikáciu vírusu SARS-CoV-2. Takéto prístupy však odmietli, a tak sa to nepodarilo.
Kalcifediol s druhou hydroxyláciou je rozpustnejší vo vode ako D3. Preto sa vstrebáva rýchlejšie, a to aj bez mechanizmov absorpcie v čreve na báze lipidov [102]. V dôsledku toho aj v prítomnosti gastrointestinálnych malabsorpčných problémov (napr. po bariatrickej operácii) [103], abnormálnej funkcie pečene a prebiehajúceho závažného ochorenia perorálny kalcifediol rýchlo zvyšuje sérové koncentrácie 25(OH)D, čo umožňuje jeho vstup do cieľových buniek.
Všetky periférne cieľové bunky vrátane imunitných a cievnych buniek, ktoré exprimujú vysoké koncentrácie CTR a CYP2R1, tak môžu konvertovať 25(OH)D na kalcitriol. V imunitných bunkách sa tento intracelulárne vytvorený kalcitriol (nie hormonálna forma v cirkulácii) spája so svojimi cytosolovými receptormi CTR za vzniku komplexov kalcitriol-CTR a premiestňuje sa do jadra, kde interaguje s DNA, ako je opísané vyššie. Iniciuje autokrinnú a parakrinnú signalizáciu v imunitných bunkách, ako je znázornené na obrázku 4.
4.4. Mechanizmy, ktorými vitamín D riadi zápal
Nedostatok vitamínu D podporuje prozápalové prostredie Th1 a Th17 buniek [16]. Naopak, dostatok intracelulárneho kalcitriolu prepína prozápalové bunky Th1 a Th17 na protizápalové bunky odpovede Th2 a Treg. Výsledné znížené uvoľňovanie zápalových cytokínov a zvýšená expresia protizápalových cytokínov zabraňujú cytokínovej búrke a ARDS [104,105]. Hlavným dôvodom, prečo Th1 a Th17 lymfocyty zostávajú počas infekcií prozápalové, je nedostatočné množstvo D3 a 25(OH)D v obehu.
Program vypínania riadený kalcitriolom konvertuje bunky Th1 na Th2 a Th17 na bunky Treg. Presmeruje prozápalové na protizápalové prostredie [16,106]. To umožňuje zamýšľané autokrinné a parakrinné signalizačné mechanizmy imunitných buniek, zníženie zápalu a zvýšenie expresie protizápalových cytokínov, IFN-ƴ, IL-10 atď. [23,107]. Na obrázku 8 je schematicky znázornené celkové pôsobenie vitamínu D na rôzne systémy organizmu vrátane modulácie vrodeného a adaptívneho imunitného systému.
obrázok 8. Rozhodujúce biologické a fyziologické funkcie kalcitriolu [1,25(OH)2D] v rôznych telesných systémoch so zameraním na imunitný systém. Intracelulárne generovaný kalcitriol stimuluje vrodený aj adaptívny imunitný systém. Základné imunologické funkcie vitamínu D, ako je protizápalová, antimikrobiálna a antioxidačná aktivita, umožňujú prekonať invazívne mikróby, ako sú baktérie a vírusy (znázornené vo fialových ováloch). Dostatok vitamínu D pozitívne moduluje bunky imunitného systému (znázornené v červených ováloch), znižuje ich množenie, zvyšuje ničenie patogénov, ako je SARS-CoV-2, a sťahuje medzery, čím zabraňuje extravazácii tekutín a šíreniu mikróbov. Nie sú zahrnuté, zvýšená expresia ACE-2 a znížená koncentrácia angiotenzínu-II, čo znižuje riziko cytokínovej búrky, syndrómu akútnej respiračnej tiesne (ARDS) a smrti (upravené podľa Wimalawansa, S.J., 2020, [16]).
Kalcitriol okrem svojich negenetických antivírusových účinkov [108] zvyšuje transkripciu viacerých antimikrobiálnych peptidov, ako sú katelicidín a defenzín. Takisto stimuluje chemotaxiu imunitných buniek [109] a znižuje závažnosť COVID-19 [110]. Očakáva sa však, že k individuálnym rozdielom v odpovediach dochádza prostredníctvom epigenetických odchýlok [106,111]. Vitamín D tiež zlepšuje funkcie Thαβ CD4+ T lymfocytov, potláča pomocné lymfocyty T17 a zvyšuje expresiu IL-10 a vírusovo špecifických protilátok IgG1 aktiváciou B lymfocytov závislých od T buniek [112].
4.5. Ako obezita spôsobuje D-hypovitaminózu, ktorá si vyžaduje vyššie dávky vitamínu D?
Triáda obezity, diabetes mellitus a metabolický syndróm sú chronické zápalové stavy nízkeho stupňa [113,114,115]. Tieto stavy sú spojené s nadbytkom vnútrobrušného zápalového tuku, D-hypovitaminózou a chronickým zápalom, ktorý zvyšuje komplikácie a predčasné úmrtia na infarkt myokardu a mozgovú príhodu. Nedostatočné množstvo biologicky dostupných substrátov [cirkulujúci D3 a 25(OH)D] vstupujúcich do cieľových imunitných buniek vedie k zlyhaniu tvorby intracelulárneho kalcitriolu. To spôsobuje hypovitaminózu spojenú s generalizovaným hyperzápalom a oxidačnou a cytokínovou búrkou [116]. Naopak, doplnky vitamínu D znižujú chronický zápal, kontrolujú hladinu cukru v krvi a znižujú komplikácie a úmrtia na tieto poruchy [117,118].
Pri obezite sú vnútrobrušné tukové bunky v zápalovom stave. Produkujú "toxické" cytokíny, ktoré potláčajú CYP2RI v pečeni [119]. Čiastočne pôsobí prostredníctvom koaktivátora peroxizómového proliferátorom aktivovaného receptora 1-a (PGC-1a)/receptora súvisiaceho s estrogénmi a glukokortikoidného receptora [114]. Okrem toho sekvestrácia sprostredkovaná tukovými bunkami, inaktivácia D3 a kalcifediolu pomocou CYP24A1 a downregulácia CYP2RI v pečeni (a možno aj v periférnych tkanivách) ďalej znižujú cirkulujúcu koncentráciu 25(OH)D [114,120]. Uvedené vysvetľuje, prečo majú osoby s obezitou vždy nízke koncentrácie 25(OH)D v sére. Na udržanie koncentrácie 25(OH)D v sére potrebujú dvoj- až štvornásobne vyššie dávky vitamínu D v prepočte na telesnú hmotnosť [9] (popis v časti 5 nižšie).
5. Dávky vitamínu D potrebné na zvýšenie sérového 25(OH)D
Na udržanie silného imunitného systému a zníženie rizika infekcií, závažných komplikácií, úmrtí a celkovej úmrtnosti sú potrebné vyššie dávky vitamínu D, ako sú všeobecne odporúčané [121]. Pre zdravého dospelého človeka s hmotnosťou 70 kg je odporúčaná suplementácia vitamínu D na udržanie sérového 25(OH)D nad 50 ng/ml približne 5000 IU/deň (medzi 4000 a 7000 IU/deň) alebo 50000 IU týždenne: pre osoby s nižšou telesnou hmotnosťou (nízkym obsahom telesného tuku/BMI) 50 000 IU, raz za dva týždne [4,12,122].
Staršie osoby a osoby s nadváhou alebo obezitou však potrebujú dvoj- až štvornásobne vyššie množstvo vitamínu D na dosiahnutie a udržanie uvedených cieľových koncentrácií v krvnom obehu, ako je opísané ďalej [5]. Osoby s vyšším rizikom vzniku infekcií a s vyšším výskytom hypovitaminózy D, ako sú obézni jedinci, starší ľudia, osoby so zníženou imunitou a osoby s komorbiditami [123,124], potrebujú oveľa vyššie dávky vitamínu D ako dospelý človek s priemernou hmotnosťou alebo mladší človek [5,12,122,125,126] (vysvetlenie pozri v časti 4.5 vyššie).
Existuje trend propagovať používanie voľného 25(OH)D ako lepšieho klinického nástroja ako akceptovaného a validovaného celkového 25(OH)D, ktorý sa rutinne meria v laboratóriách na celom svete. Napriek tomu iné uvádzané štúdie nepreukázali žiadnu výhodu takéhoto postupu [127,128]. Okrem toho neexistujú významné genetické alebo rasové rozdiely v koncentráciách VDBP ani v afinite DBP k trom uvedeným ligandom vitamínu D.
V dôsledku toho vypočítaný alebo nameraný voľný 25(OH)D rovnako dobre koreluje s celkovým 25(OH)D [129]. Taktiež koncentrácie voľného 25(OH)D a kalcitriolu sa zvyšujú pri rôznych ochoreniach, ako je cirhóza, čo znemožňuje zmysluplnú interpretáciu voľných koncentrácií [130]. Najdôležitejšie je, že keďže voľné aj na VDBP viazané formy D3 a 25(OH)D vstupujú do cieľových buniek, ako sú imunitné bunky, sú biologicky významné. Preto spoliehanie sa na namerané voľné zložky 25(OH)D v obehu nemá pridanú hodnotu a v klinickej praxi je zavádzajúce; preto by sa mu malo vyhnúť.
5.1. Príjem vitamínu D potrebný na udržanie sérových koncentrácií 25(OH)D > 50 ng/ml
Cirkulačný polčas 25(OH)D je menej ako 20 dní (pohybuje sa od 12 do 24 dní v závislosti od veku a stavu vitamínu D). Preto by sa na udržanie žiaducej, stabilnej terapeutickej koncentrácie 25(OH)D v sére mala suplementácia vitamínom D podávať v intervaloch nie dlhších ako dva týždne [118]. Keďže hepatálna 25-hydroxylácia (CYP2R1) je rýchlostne limitujúcim krokom, predbežné nasadzovacie dávky, dokonca aj prekračujúce bolusovú dávku 300 tisíc IU, potrebujú tri až štyri dni na zvýšenie sérových koncentrácií 25(OH)D.
Avšak jednorazové podanie v závislosti od dávky udržiava vyššiu koncentráciu 25(OH)D v sére až tri mesiace [2,66,123,124]. Na dlhšie udržiavanie sú potrebné denné alebo týždenné udržiavacie dávky. Zatiaľ čo jednorazové podanie bolusu alebo vysokej dávky je bezpečné, opakované vyššie dávky regulujú CYP24A1. Preto pravdepodobne zvyšujú inaktiváciu (katabolizmus) D3, 25(OH)D a 1,25(OH)2D. Následne zhoršuje niektoré fyziologické funkcie vitamínu D, hlavne hormonálne funkcie vitamínu D (pozri časť 1.1): posledné nepriaznivé účinky by mohli trvať až tri mesiace [66].
Preto bez ohľadu na dávky vitamínu D3 použité na zvýšenie sérovej koncentrácie 25(OH)D môže u ťažko chorých, ako napríklad u kriticky chorých na jednotke intenzívnej starostlivosti, trvať zvýšenie sérovej koncentrácie 25(OH)D až týždeň. Preto by sa lekári nemali spoliehať na rodičovské doplnky vitamínu D na rýchle posilnenie imunitného systému u ťažko chorých pacientov [89,131]. Nemá to žiadny prínos, ale mohlo by to spôsobiť závažné nežiaduce účinky. V týchto situáciách je podávanie perorálneho kalcifediolu [25(OH)D] v dávke 0,5 až 1,0 mg (0,014 mg/kg telesnej hmotnosti) najúčinnejším a najbezpečnejším spôsobom rýchleho zvýšenia sérovej koncentrácie 25(OH)D a posilnenia imunitného systému. Jednoduchý spôsob výpočtu potrebnej dávky je znázornený v tabuľke 1, ak je k dispozícii koncentrácia 25(OH)D v sére.
5.2. Praktické spôsoby použitia vyšších dávok suplementácie vitamínu D3
Vzhľadom na ich širokú dostupnosť, praktickosť, cenovú dostupnosť a lepšiu gastrointestinálnu absorpciu sa pri potrebe vyšších množstiev vitamínu D ako náhradných dávok odporúča používať kapsuly 50 tisíc IU D3, čo je nákladovo najefektívnejší prístup. Praktický spôsob ich použitia na zvýšenie koncentrácie 25(OH)D v sére a jej udržanie v neurgentných situáciách, u ambulantných pacientov a v komunite je znázornený v tabuľke 1. Potrebný počet kapsúl sa môže užívať ako bolusová dávka 100 000 až 400 000 IU (jednorazové dávky vopred) alebo v rozdelených denných dávkach s jedlom, ako je znázornené v tabuľke 1.
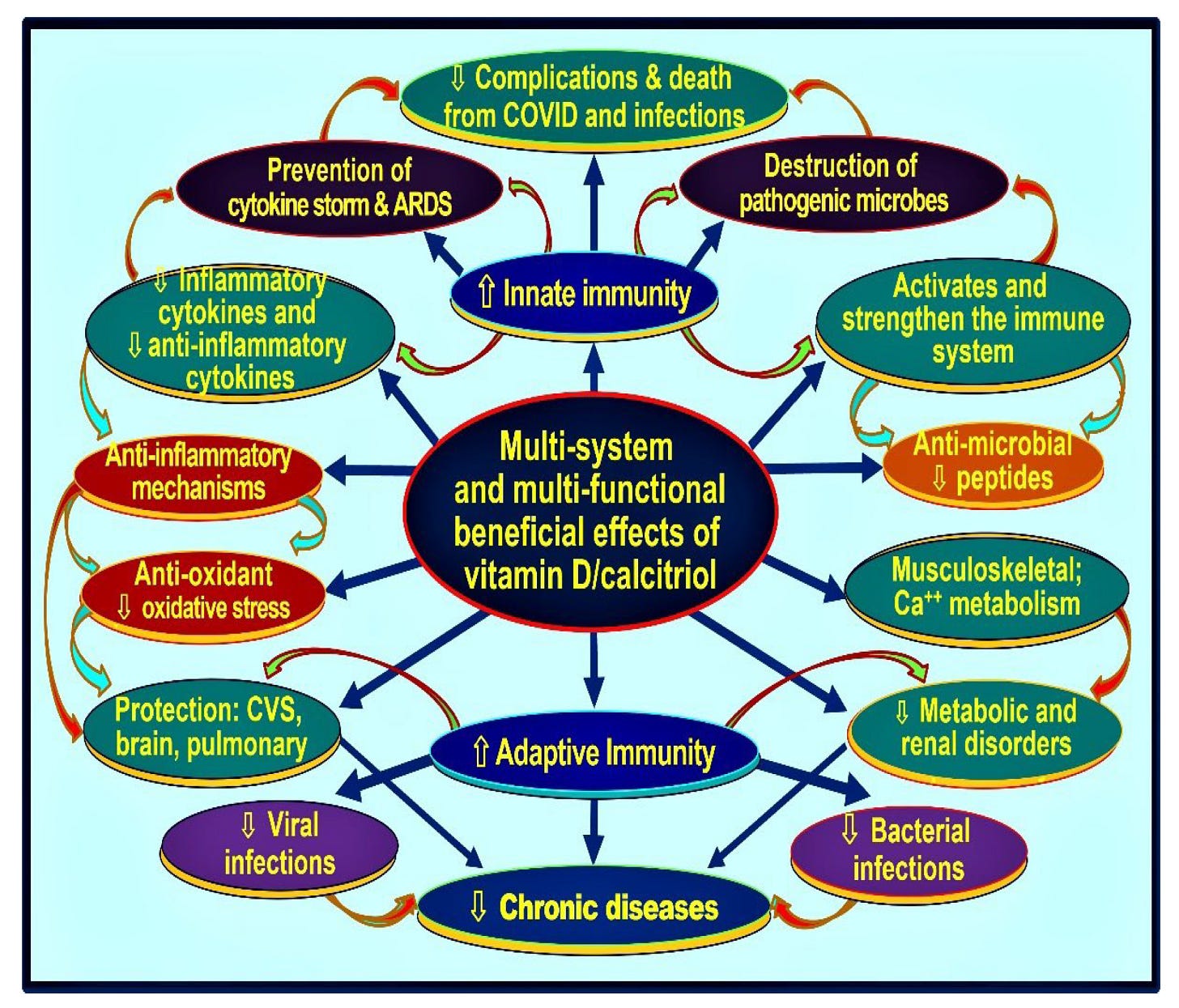
Tabuľka 1. Ak sú k dispozícii sérové hladiny vitamínu D, dávky uvedené v tejto tabuľke sa môžu použiť na dlhodobejšie udržanie sérovej koncentrácie 25(OH)D nad 50 ng/ml (125 nmol/l). V tabuľke sa uvádza počiatočná bolusová dávka, týždenná dávka, frekvencia a dĺžka podávania perorálneho vitamínu D v situáciách, ktoré nie sú naliehavé, u dospelého človeka bez obezity s hmotnosťou 70 kg. * (upravené podľa Wimalawansa, S.J., 2012) [132,133]).
* Vhodná denná alebo týždenná udržiavacia dávka, ktorá sa má začať podávať po ukončení schémy nasycovacích dávok. Dávka by sa mala upraviť pre osoby s nadváhou (vyššia) alebo podváhou (nižšia). ** Na prepočet ng/ml na nmol/l vynásobte množstvo v ng číslom 2,5; jeden µg = 40 IU. $ Spomínané náhradné dávky sa môžu užívať ako jednorazové, kumulatívne dávky, dva až trikrát týždenne rozložené na niekoľko týždňov. $$ Od prvého dňa druhého týždňa. # Odhadovaná celková dávka vitamínu D potrebná na doplnenie telesných zásob (t. j. deficit) je uvedená v poslednom stĺpci.
V tabuľke 1 je uvedený bezpečný a praktický plán, keď je známa koncentrácia 25(OH)D v sére [132,133]. Keďže pečeňový enzým CYP 25-hydroxyláza je limitujúcim faktorom rýchlosti (ale nie nevyhnutne v periférnych cieľových bunkách, ako sú bunky imunitného systému). Preto v situáciách, ktoré nie sú naliehavé, užívanie kapsúl D3 50 tisíc IU rozložených na niekoľko dní poskytuje lepšiu absorpciu a biologickú dostupnosť ako užívanie celkového množstva ako bolusovej dávky. Ako je znázornené v tabuľke 1, tkanivový deficit sa dá vhodne doplniť kapsulami s obsahom 50 tisíc IU, čo umožňuje telu vytvoriť stabilnú sérovú koncentráciu 25(OH)D v priebehu troch až piatich dní a udržať ju dlhšie.
V niekoľkých RCT sa vitamín D podával aj každé dva týždne s úspešnými klinickými výsledkami [28,134,135,136,137,138,139]. Na účinnú kontrolu infekcií alebo iných porúch, ako je uvedené vyššie, sa však odporúča podávať vitamín D denne alebo raz týždenne; frekvenciu podávania však nezvyšovať dlhšie ako desať dní.
5.3. Odporúčané dávky na udržanie terapeutickej koncentrácie 25(OH)D v sére
Na správne fungovanie periférnych cieľových buniek a na prekonanie infekcií existujú dôkazy, že je potrebné udržiavať cirkulujúce koncentrácie 25(OH)D nad 50 ng/ml. To sa dá dosiahnuť podávaním dávok vitamínu D, napríklad 5000 IU (125 µg/deň) alebo 50 tisíc IU (1,25 mg) raz alebo raz za dva týždne.
To je v protiklade s dennými dávkami 400 až 1000 IU (ekvivalent 10 až 25 µg), ktoré v súčasnosti odporúča väčšina vlád, Inštitút medicíny (IoM)-Amerika [teraz Národná akadémia medicíny], Európsky úrad pre bezpečnosť potravín (EFSA), Vedecký poradný výbor pre výživu Spojeného kráľovstva (SACN, UK), National Institute of Health & Care Excellence (NICE, UK) a niektoré európske krajiny a ich odporúčania na udržiavanie minimálnej cirkulujúcej koncentrácie 25(OH)D nad 20 ng/ml (50 nmol/l) [20,140].
Laboratórne zariadenia na meranie sérových koncentrácií 25(OH)D sú síce dostupné vo väčšine priemyselných krajín, ale sú drahé. Vo väčšine ostatných krajín nie sú merania 25(OH)D dostupné, a tak spoliehanie sa na prepravu vzoriek do zahraničia zvyšuje náklady. Ako však ukazuje tabuľka 2, výsledky sérových koncentrácií 25(OH)D nie sú nevyhnutné na bezpečné posúdenie potrebných substitučných dávok. Náhradnú liečbu možno vykonať bez nežiaducich účinkov, ak osoba neužívala vysoké dávky doplnkov vitamínu D. Pri závažnom symptomatickom nedostatku vitamínu D (t.j. s proximálnou myopatiou panvového pletenca) sa pri použití vyššej dávky replécie D3, ako je uvedené v tabuľke 1 alebo v tabuľke 2, pacientom zvyčajne do dvoch až troch týždňov vrátia bežné denné aktivity, ako je chôdza a starostlivosť o seba.
Hoci existujú protokoly, v ktorých by sa potrebné dávky vitamínu D mohli vypočítať na základe telesnej hmotnosti [5], žiadny z nich nie je určený na dosiahnutie alebo udržanie sérových koncentrácií 25(OH)D na terapeutických hladinách nad 50 ng/ml. Ak nie je známa koncentrácia 25(OH)D v sére, zdravotnícki pracovníci môžu pohodlne použiť praktický návod uvedený v tabuľke 2: spoľahlivý spôsob, ako doplniť tkanivové zásoby a udržať koncentrácie 25(OH)D v sére nad minimálnou terapeutickou koncentráciou, aby mali klinický prínos z vitamínu D.
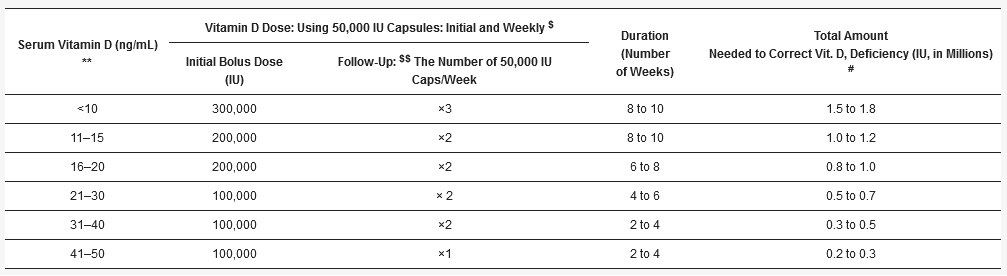
Pre priemerné zdravé osoby bez obezity sa vypočítajú dávky na základe hmotnosti 70 až 90 IU/kg/deň. Pre osoby s obezitou 90 až 130 IU/kg/deň a pre morbídnu obezitu 140 až 180 IU/kg/deň. Pri extrémnej obezite sa môže zvýšiť až na 200 IU/kg/deň. Informácie uvedené v tabuľke 1 (ak je známa koncentrácia 25(OH)D v sére) alebo v tabuľke 2 (s použitím pomerov telesnej hmotnosti, ak 25(OH)D nie je známy) možno použiť na začatie a dlhodobejšie udržiavanie koncentrácie 25(OH)D v sére [4,45,141].
Tabuľka 2. Dlhodobejšie udržiavacie schémy perorálneho vitamínu D na základe telesnej hmotnosti na udržanie hladín nad 50 ng/ml (125 nmol/l), keď nie sú známe koncentrácie 25(OH)D v sére.
* Príklad rozmedzia denných alebo jednorazových dávok pre dospelých so špecifickými telesnými typmi (na základe BMI pre bielych kaukazanov a telesnej hmotnosti pre ostatné etnické skupiny). U detí je potrebné vhodné zníženie dávky. # Pre osoby s chronickými komorbidnými ochoreniami, ako sú hypertenzia, cukrovka, astma, CHOCHP, CKD, depresia a osteoporóza, a na zníženie úmrtnosti zo všetkých príčin sú potrebné vyššie dávky vitamínu D. Pre nich možno použiť dávky, ktoré sa odporúčajú pre osoby s obezitou (BMI, 30-39: tretí riadok). $ Osoby so sklerózou multiplex, rakovinou, migrénou a psoriázou a osoby, ktoré bežne užívajú lieky, ako sú antiepileptiká a antiretrovírusové látky, ktoré výrazne zvyšujú katabolizmus vitamínu D, by mali zvážiť užívanie dávok zodpovedajúcich veku, ktoré sa odporúčajú pre osoby s morbídnou obezitou (BMI ≥ 40; vyššia hranica denných dávok vo štvrtom riadku).
Používanie počiatočných dávok vitamínu D3 opísaných v tabuľke 1 a tabuľke 2, posúva priaznivé klinické účinky v priebehu niekoľkých dní namiesto čakania niekoľko mesiacov so štandardnými dennými alebo týždennými dávkami. Zdvojnásobenie odporúčanej dennej dávky (napr. na 10000 IU) na niekoľko mesiacov a jej následné zníženie na štandardnú dávku skracuje čas na dosiahnutie terapeutického cieľa v obehu na niekoľko týždňov.
V odporúčaní č. 37 usmernení 2018-ESPEN sa uvádza, že 500 tisíc UI vitamínu D3 sa môže bezpečne podávať ako jednorazová dávka bez akýchkoľvek nežiaducich účinkov [142]. Odporúčané väčšie bolusové alebo nasycovacie dávky vitamínu D, od 100 do 400 tisíc IU, urýchľujú zamýšľaný prínos v priebehu troch až piatich dní [142]. Mnohé strednodobé RCT potvrdili výrazne lepšie klinické výsledky pri používaní kapsúl vitamínu D3 50 tisíc IU, podávaných (na základe klinickej požiadavky) buď raz alebo viackrát týždenne alebo raz za dva týždne, vrátane prevencie symptomatického SARS-CoV-2 [28,134,135,136,137,138,139].
5.4. Význam rodičovského vitamínu D a 25(OH)D pre tvorbu kalcitriolu v cieľových bunkách
Zatiaľ čo vyššie uvedený text bol zameraný na kalcifediol a kalcitriol ako liečebné prostriedky pre zdravie a choroby, existujú dôkazy o význame rodičovskej formy vitamínu D v ľudskej biológii [11]. V bežnej klinickej činnosti a RCT by sa však malo vyhýbať menej častému podávaniu (napr. intervaly viac ako raz za dva týždne) a prerušovanému podávaniu vysokých dávok alebo opakovanému bolusovému dávkovaniu, ktoré nie je prospešné [58].
Väčšina steroidných hormónov sa dostáva do buniek prostredníctvom difúzie a endocytózy, ako je to v obličkách a prištítnych telieskach, prostredníctvom megalinového a kubilínového systému opísaného vyššie: a vo svalových a tukových bunkách [11,143]. Evolučne je tento aktívny mechanizmus vstupu D3 a 25(OH)D do buniek nastavený tak, že prioritne zásobuje obličkové tubuly a prištítne telieska endokrinnými funkciami vitamínu D, a to aj vtedy, keď sú koncentrácie v sére nízke (napr. 20 ng/ml). Takto je schopný vytvárať hormonálnu formu kalcitriolu, ktorá je potrebná pre metabolizmus vápnika a muskuloskeletálny systém [12,144].
Mnohé iné periférne cieľové bunky nemajú megalín-kubilínový systém. Preto sú pri difúzii vitamínu D a 25(OH)D (voľného aj voľne viazaného na VDBP a albumín) a v niektorých prípadoch aj pri endocytóze [cirkulujúceho D3 a 25(OH)D viazaného na VDBP] do periférnych cieľových buniek závislé od koncentračného gradientu [9]. Na základe difúznych konštánt, ako je znázornené na obrázku 1, je 25(OH)D pevnejšie viazaný na VDBP ako vitamín D [59]. Okrem toho afinita týchto molekúl k VDBP určuje trvanie týchto zlúčenín v cirkulácii (t.j. cirkulačný polčas). Tieto dôkazy naznačujú, že za normálnych okolností má vitamín D väčšiu schopnosť ako 25(OH)D dostať sa do cieľových tkanív, ako sú imunitné bunky, prsník, keratinocyty, mozog a gastrointestinálne epitely. Hoci sú cirkulujúce koncentrácie relatívne podobné, vitamín D difunduje voľnejšie ako 25(OH)D do periférnych cieľových buniek z cirkulácie 25(OH)D, pretože je menej pevne viazaný na VDBP.
Preto sa očakáva, že do cieľových buniek sa dostane viac vitamínu D ako 25(OH)D, ktorý sa 25-hydroxyluje a následne 1α-hydroxyluje za vzniku kalcitriolu. Ak je to tak, súčasný zlatý štandard, teda samotná nameraná koncentrácia 25(OH)D v sére, nemusí poskytovať vhodné informácie alebo presný obraz o stave vitamínu D. V dôsledku toho je nepravdepodobné, že by samotná koncentrácia 25(OH)D v sére poskytovala úplné informácie o dostatočnosti vitamínu D a o požiadavkách na funkcie mimokostrových cieľových buniek (obrázok 1). To zdôrazňuje dôležitosť podávania vitamínu D (správne množstvo a frekvencia na udržanie stabilných hladín a pre pretrvávajúce účinky). Použitie kalcifediolu (na rýchle pôsobenie) v núdzových situáciách sa rozoberá v ďalšej časti.
5.5. Odporúčané dávky kalcifediolu na zvýšenie sérovej koncentrácie 25(OH)D a imunity proti COVID-19
Na zabezpečenie robustných funkcií vrodenej a adaptívnej imunity je potrebné stimulovať imunitné bunky intracelulárne vytvoreným kalcitriolom. Tým sa iniciujú autokrinné/intrakrinné a parakrinné signalizačné procesy, ktoré sú kľúčové pre potlačenie zápalových cytokínov a nadmerných oxidačných procesov v tkanivách [145,146,147,148] (obrázok 5). Podávanie kalcifediolu ako jednorazovej dávky s vysokou dávkou vitamínu D alebo samostatne ako týždennej dávky významne znižuje závažnosť syndrómu akútnej respiračnej tiesne (ARDS) u osôb s COVID-19 a inými infekciami [78,79].
Niekoľko nedávnych systematických prehľadov dospelo k záveru, že podobne ako v prípade rodičovského vitamínu D sa pri včasnom podávaní kalcifediolu zaznamenalo významné zníženie komplikácií, hospitalizácií na jednotke intenzívnej starostlivosti a úmrtnosti na COVID-19 [149,150]. Jednorazová dávka kalcifediolu môže zvýšiť koncentrácie 25(OH)D do terapeutického rozsahu do štyroch hodín [151] bez negatívnych následkov [33]. Preto je v naliehavých prípadoch, ako sú prítomné infekcie COVID-19, ideálnym prístupom. Odporúčaná jednorazová perorálna dávka kalcifediolu v závislosti od telesnej hmotnosti, 0,014 mg/kg (tabuľka 3), posilňuje imunitný systém v priebehu jedného dňa. Ak nie sú k dispozícii vyššie dávky vitamínu D, rovnakú dávku kalcifediolu možno opakovať každý týždeň.
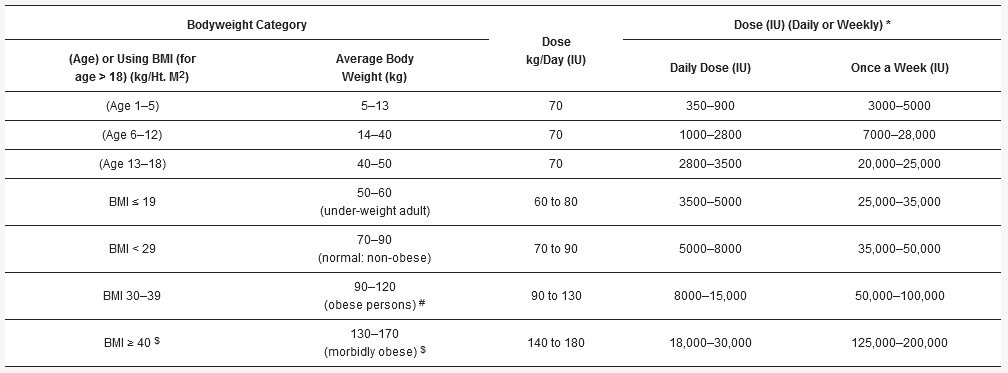
Tabuľka 3. Použitie režimu kalcifediolu * na rýchle zvýšenie koncentrácie 25(OH)D v sére nad 50 ng/ml (125 nmol/l) v naliehavých lekárskych prípadoch (t. j. na zvýšenie sérovej hladiny do štyroch hodín). ** Vypočíta sa jednorazová perorálna dávka na základe telesnej hmotnosti: 0,014 mg/kg telesnej hmotnosti.
* Kalcifediol [čiastočne aktivovaný vitamín D3, 25(OH)D]. ** Použite čo najskôr u osoby s COVID-19, sepsou, Kawasakiho chorobou, multisystémovým zápalovým syndrómom, syndrómom akútnej respiračnej tiesne, popáleninami a nedostatkom vitamínu D na začiatku tehotenstva a inými klinickými naliehavými prípadmi. # Meranie (alebo koncentrácie) sérového 25(OH)D nie je potrebné. ## Ak nie je k dispozícii kalcifediol, podáva sa ekvivalentná dávka vitamínu D, ako je znázornené v tabuľke 2, najlepšie v rozdelených dávkach počas troch až piatich dní. Bez ohľadu na použitý režim je potrebné denne alebo týždenne podávať udržiavaciu dávku vitamínu D, ako je opísané v texte.
Ak kalcifediol nie je k dispozícii, možno ho nahradiť kumulatívnymi dávkami vitamínu D3, ako je znázornené v poslednom stĺpci tabuľky 3. Súbežné podávanie kalcifediolu s vysokou (bolusovou) dávkou vitamínu D, ako je opísané v tabuľke 1 a tabuľke 2, nielenže udržiava sérovú koncentráciu 25(OH)D na terapeutickej úrovni, ale pokrýva aj obdobie počas akútneho ochorenia a jeho zotavovania, a to počas niekoľkých týždňov. Tento režim je ekonomický na zvýšenie koncentrácie 25(OH)D v sére tak, aby sa rýchlo dostala nad 50 ng/ml bez merania koncentrácie 25(OH)D v sére. Odporúča sa spolupráca s informovaným lekárom so skúsenosťami.
6. Zdôvodnenie použitia bolusových dávok vitamínu D3 a kalcifediolu v naliehavých prípadoch
Perorálny kalcifediol sa ľahko absorbuje v hornej časti gastrointestinálneho traktu a je o tretinu lepšie absorbovaný ako rodičovský D3 [64,102]. Vďaka dvojitej hydroxylácii má kalcifediol lepšiu rozpustnosť a absorpčný profil ako vitamín D. Obchádza tiež kritický krok limitujúci rýchlosť [144], 25-hydroxyláciu prostredníctvom CYP2R1 v pečeni. Preto na rozdiel od perorálneho D3, kde pacienti musia čakať niekoľko dní, kalcifediol zvyšuje sérovú koncentráciu 25(OH)D v priebehu niekoľkých hodín [62,63,151].
Keď sa účinnosť kalcifediolu prepočíta na základe hmotnosti na zvýšenie koncentrácie 25(OH)D v sére (t. j. biologická dostupnosť), je 3,2 až 4-krát účinnejší ako D3 [151]. Na zjednodušenie výpočtu je rozumné považovať kalcifediol za štyrikrát účinnejší ako D3. Napríklad pri podávaní 25 µg/deň ekvivalent 1 µg D3 zvýšil sérový 25(OH)D o 1,5 ± 0,9 nmol/l, zatiaľ čo jeden µg kalcifediolu zvýšil 25(OH)D o 4,8 ± 1,2 nmol/l [151].
Neexistuje dôvod na používanie analógov kalcifediolu
Medzi kalcifediolom a jeho analógmi s predĺženým uvoľňovaním nie sú žiadne významné fyziologické alebo farmakologické rozdiely. Napríklad, zatiaľ čo bežný kalcifediol zvyšuje sérové koncentrácie 25(OH)D za štyri hodiny, prípravky s predĺženým uvoľňovaním to isté dosiahnu za tri hodiny [151,152]. Pri výrazne vyššej cene analógov/formulácií (paralelne s 1α-analógmi kalcitriolu) nie je výhodné používať ich namiesto kalcifediolu. Dôvodom zavedenia týchto syntetických analógov bolo ich odlíšenie od pôvodnej molekuly, kalcifediolu, len s cieľom získať ochranné patenty na marketingové účely.
Farmakodynamické štúdie uvádzajú, že cirkulačný polčas kalcifediolu je 12 až 21 dní [151]. Preto sa môže podávať týždenne pri niekoľkých špecifických indikáciách, ako je zlyhanie pečene, po Roux-en-Y žalúdočnom bypasse [103] a morbídnej obezite [119], kde je indikované strednodobé alebo dlhodobé podávanie kalcifediolu [151]. V prípade, že neexistuje uvedená situácia, podávanie opakovaných dávok kalcifediolu alebo jeho analógov ako doplnku vitamínu D (vrátane chronického zlyhania obličiek) na udržanie sérového 25(OH)D je neopodstatnené a finančne neefektívne.
Väčšina syntetických analógov vitamínu D nepodlieha typickej fyziologickej spätnej väzbe ako pôvodné zlúčeniny vitamínu D. V dôsledku toho majú výrazne vyššie riziko nežiaducich účinkov [144]. Na základe fyziológie, nežiaducich účinkov a nákladov nie je dôvod používať kalcifediol alebo jeho drahé analógy ako rutinnú suplementáciu vitamínu D alebo pri zlyhaní obličiek pri D-hypovitaminóze. Osoby s pokročilým zlyhaním obličiek (s normálnymi funkciami pečene) potrebujú rodičovský D3 a kalcitriol (alebo jeho analógy), nie kalcifediol alebo jeho analógy.
V prípade mnohých osôb s nedostatkom vitamínu D so sepsou [10] alebo COVID-19 [21,22,23,60] (t. j. v urgentných prípadoch), s ktorými sa stretávame na klinikách alebo ktoré sú prijaté do nemocníc, je nepravdepodobné, že by boli k dispozícii informácie o ich sérových koncentráciách 25(OH)D. Pre nich môže byť život zachraňujúce podanie správnej dávky vitamínu D v závislosti od telesnej hmotnosti (tab. 1) alebo jednorazovej dávky 0,014 mg/kg telesnej hmotnosti kalcifediolu (tab. 3). To je približne 1,0 mg u neobézneho dospelého s hmotnosťou 70 kg a 0,5 mg u dospievajúceho. Takéto dávky sú dostatočné na rýchle zvýšenie sérového 25(OH)D na potrebnú terapeutickú koncentráciu (tabuľka 3). Obézni potrebujú vyššiu (dvojnásobnú) dávku.
7. Závery
Silný imunitný systém je nevyhnutný na prekonanie infekcií bez komplikácií. Závisí od adekvátneho vstupu vitamínu D3 a 25(OH)D do imunitných buniek na tvorbu kalcitriolu. Ten si vyžaduje udržiavanie sérovej koncentrácie 25(OH)D nad 50 ng/ml. Preto je na úspešné zvládnutie a prekonanie infekčnej epidémie alebo pandémie nevyhnutné udržiavať koncentráciu 25(OH)D v sére populácie nad uvedenou terapeutickou úrovňou.
U akútne chorých osôb, najmä u osôb s nedostatkom vitamínu D, ktoré majú infekcie, je rýchle zvýšenie sérových koncentrácií D3 a 25(OH)D prvoradé a život zachraňujúce. V týchto naliehavých situáciách môže 0,5 až 1,0 mg kalcifediolu zvýšiť sérové koncentrácie 25(OH)D nad minimálnu terapeutickú hladinu 50 ng/ml do štyroch hodín a v priebehu jedného dňa posilniť imunitný systém, čo uľahčuje prekonanie infekcií.
Zatiaľ čo kalcifediol zvyšuje sérový 25(OH)D v priebehu niekoľkých hodín, pri perorálnom podávaní aj vysokých dávok vitamínu D trvá zvýšenie sérových koncentrácií 25(OH)D tri až päť dní. Toto oneskorenie je spôsobené jeho menej účinnou absorpciou ako v prípade kalcifediolu a potrebou, aby vitamín D prešiel 25-hydroxyláciou v pečeni, čo je krok limitujúci rýchlosť. U akútne chorých pacientov, ako napríklad u pacientov na jednotke intenzívnej starostlivosti, môže podávanie aj vysokých dávok perorálneho D3 trvať týždeň, kým sa zvýši koncentrácia 25(OH)D v sére. Preto nie je užitočné v naliehavých prípadoch, ako sú infekcie SARS-CoV-2.
Pri podaní jednorazovej dávky kalcifediolu podľa hmotnosti, ako je opísané v tabuľke 3, sa koncentrácie 25(OH)D v obehu udržiavajú približne 8 až 14 dní. Naopak, rodičovská vysoká dávka vitamínu D3, podávaná ako náplň alebo bolus, udrží sérové koncentrácie 25(OH)D dva až tri mesiace. Hoci je cirkulačný polčas D3 krátky, v dôsledku väčších počiatočných dávok udržiava vyššiu cirkulujúcu koncentráciu D3 aj 25(OH)D počas niekoľkých týždňov – čiastočne z dôvodu uvoľňovania zo zásob v tukových a svalových tkanivách.
Preto by sa pri kalcifediole mala podávať vhodná vyššia dávka vitamínu D3. To sa dá urobiť pomocou kapsúl s 50 tisíc IU vitamínu D v ambulantných nastaveniach a v urgentných prípadoch, ako je znázornené v tabuľke 3. Napriek tomu, ak vezmeme do úvahy negenetické priaznivé účinky vitamínu D3 a jeho dlhšie trvanie fyziologických účinkov opísané vyššie, kombinácia D3 a kalcifediolu poskytuje lepšie klinické výsledky ako jeden z nich samostatne. Preto sa podávanie správnych dávok D3 a kalcifediolu odporúča u pacientov s infekciami ako doplnková liečba pri prvom ambulantnom alebo hospitalizačnom stretnutí.
Viaceré pozorovania a RCT preukázali, že sérové koncentrácie 25(OH)D (pred infekciou alebo pri prijatí) nepriamo korelovali s výskytom, závažnosťou a mierou úmrtnosti na COVID-19 [45,55,56,153]. Pritom suplementácia vitamínom D významne znižuje komplikácie a úmrtia [33,44,45,150,154]. Bez ohľadu na režim by po úvodných bolusových alebo nasycovacích dávkach vitamínu D a/alebo kalcifediolu mal nasledovať denný alebo týždenný, dlhodobejší udržiavací režim [11,118,155].
Opísané schémy v troch tabuľkách sú vysoko nákladovo efektívne spôsoby, ako zvýšiť sérové koncentrácie 25(OH)D a udržiavať ich, aby sa imunitný systém udržal vo vysokej pohotovosti. Následne sa tak predchádza a/alebo znižuje výskyt infekcií a komplikácií spôsobených COVID-19 a inými infekciami. Pre dospelých bez obezity s hmotnosťou 70 kg je odporúčaná dlhodobejšia udržiavacia dávka vitamínu D3 5000 IU/(0,125 µg) denne alebo 50 tisíc IU (1,25 mg)/týždeň (alebo každých desať dní). Napriek tomu tento režim trvá niekoľko mesiacov, kým sa dosiahne požadovaná koncentrácia 25(OH)D v sére nad 50 ng/ml. Možno ju urýchliť príjmom vitamínu D, 10000 IU/deň (250 µg/deň) počas 8 až 10 týždňov a návratom k dennej dávke 5000 IU.
Náprava nedostatku vitamínu D stojí menej ako 0,1% nákladov spojených s hodnotením a liečbou komorbidít a komplikácií spojených s nedostatkom vitamínu D [156]. Napríklad v západných krajinách stojí suplementácia vitamínu D na udržanie sérového 25(OH)D približne 8 USD na osobu/rok v porovnaní s priemernými nákladmi na liečbu ochorení spojených s nedostatkom vitamínu D a súvisiacich komplikácií vo výške 5000 až 15000 USD/rok na osobu [156]. Napriek priaznivému pomeru nákladov a prínosov, dostupnosti ako voľnopredajnej živiny a príkladnému bezpečnostnému profilu milióny ľudí ochorejú v dôsledku nedostatku vitamínu D, ktorý si vyžaduje lekársku pomoc, čo výrazne zvyšuje náklady na zdravotnú starostlivosť. Nedostatok vitamínu D zvyšuje náklady na zdravotnú starostlivosť, absenciu a alternatívne náklady a znižuje produktivitu.
Vzhľadom na opísané významné prínosy spojené s prevenciou ochorení, znížením závažnosti ochorení, znížením absencií, komplikácií a úmrtí, zlepšením pohody a vyššou produktivitou, vypočítaný celkový pomer nákladov a prínosov podávaných doplnkov vitamínu D3 presahuje 1 ku 20000. Napriek týmto údajom zatiaľ žiadna krajina neodporúča vitamín D (ani nezverejnila správne usmernenia so správnymi dávkami) na prevenciu chorôb alebo ho neodporúča ako doplnkovú liečbu na prevenciu komplikácií a úmrtí na infekcie alebo iné ochorenia. Táto správa poskytuje zdôvodnenie, odôvodnenie, priame pokyny a praktické tabuľky, ktoré poskytujú režimy na použitie v klinickej praxi na dosiahnutie a udržanie sérových koncentrácií 25(OH)D potrebných na zabezpečenie silného imunitného systému, ktorý pomáha prekonať infekcie vrátane SARS-CoV-2.
preklad: Kishitusumo Takadonomi –> https://tinyurl.com/yxxk3y9a
Ďalšie zaujímavé čítanie nájdete tiež na adresách:
References
Lips, P.; Jongh, R.T.; Schoor, N.M. Author response for “Trends in vitamin D status around the world”. JBMR Plus 2021, 5, e10414. [Google Scholar] [CrossRef] [PubMed]
Cashman, K.D.; Kiely, M.E.; Andersen, R.; Grønborg, I.M.; Tetens, I.; Tripkovic, L.; Lanham-New, S.A.; Lamberg-Allardt, C.; Adebayo, F.A.; Gallagher, J.C.; et al. Individual participant data (IPD)-level meta-analysis of randomised controlled trials to estimate the vitamin D dietary requirements in dark-skinned individuals resident at high latitude. Eur. J. Nutr. 2021, 61, 1015–1034. [Google Scholar] [CrossRef] [PubMed]
Pludowski, P.; Holick, M.F.; Grant, W.B.; Konstantynowicz, J.; Mascarenhas, M.R.; Haq, A.; Povoroznyuk, V.; Balatska, N.; Barbosa, A.P.; Karonova, T.; et al. Vitamin D supplementation guidelines. J. Steroid Biochem. Mol. Biol. 2017, 175, 125–135. [Google Scholar] [CrossRef]
Mocanu, V.; Vieth, R. Three-year follow-up of serum 25-hydroxyvitamin D, parathyroid hormone, and bone mineral density in nursing home residents who had received 12 months of daily bread fortification with 125 mug of vitamin D(3). Nutr. J. 2013, 12, 137. [Google Scholar] [CrossRef]
Ekwaru, J.P.; Zwicker, J.D.; Holick, M.F.; Giovannucci, E.; Veugelers, P.J. The importance of body weight for the dose re-sponse relationship of oral vitamin D supplementation and serum 25-hydroxyvitamin D in healthy volunteers. PLoS ONE 2014, 9, e111265. [Google Scholar] [CrossRef] [PubMed]
Kearns, D.M.; Alvarez, J.A.; Tangpricha, V. Large, single-dose, oral vitamin D supplementation in adult populations: A systematic review. Endocr. Pract. 2014, 20, 341–351. [Google Scholar] [CrossRef]
Díaz, L.; Díaz-Muñoz, M.; García-Gaytán, A.C.; Méndez, I. Mechanistic Effects of Calcitriol in Cancer Biology. Nutrients 2015, 7, 5020–5050. [Google Scholar] [CrossRef]
Ledderose, C.; Bao, Y.; Zhang, J.; Junger, W.G. Novel method for real-time monitoring of ATP release reveals multiple phases of autocrine purinergic signalling during immune cell activation. Acta Physiol. 2014, 213, 334–345. [Google Scholar] [CrossRef]
Bikle, D.D. Vitamin D regulation of immune function during COVID. Rev. Endocr. Metab. Disord. 2022, 23, 279–285. [Google Scholar] [CrossRef]
Wimalawansa, S.J. Biology of Vitamin D. J. Steroids Horm. Sci. 2019, 10, 1–8. [Google Scholar]
Moore, D.D.; Kato, S.; Xie, W.; Mangelsdorf, D.J.; Schmidt, D.R.; Xiao, R.; Kliewer, S.A. International Union of Pharmacology. LXII. The NR1H and NR1I receptors: Constitutive androstane re-ceptor, pregnene X receptor, farnesoid X receptor alpha, farnesoid X receptor beta, liver X receptor alpha, liver X receptor be-ta, and vitamin D receptor. Pharmacol. Rev. 2006, 58, 742–759. [Google Scholar] [CrossRef] [PubMed]
Wimalawansa, S.J. Non-musculoskeletal benefits of vitamin D. J. Steroid Biochem. Mol. Biol. 2018, 175, 60–81. [Google Scholar] [CrossRef] [PubMed]
Gueli, N.; Verrusio, W.; Linguanti, A.; Di Maio, F.; Martinez, A.; Marigliano, B.; Cacciafesta, M. Vitamin D: Drug of the future. A new therapeutic approach. Arch. Gerontol. Geriatr. 2012, 54, 222–227. [Google Scholar] [CrossRef] [PubMed]
Grant, W.B.; Al Anouti, F.; Boucher, B.J.; Dursun, E.; Gezen-Ak, D.; Jude, E.B.; Karonova, T.; Pludowski, P. A Narrative Review of the Evidence for Variations in Serum 25-Hydroxyvitamin D Concentration Thresholds for Optimal Health. Nutrients 2022, 14, 639. [Google Scholar] [CrossRef]
Quraishi, S.A.; Bittner, E.A.; Blum, L.; Hutter, M.M.; Camargo, C.A. Association Between Preoperative 25-Hydroxyvitamin D Level and Hospital-Acquired Infections Following Roux-en-Y Gastric Bypass Surgery. JAMA Surg. 2014, 149, 112–118. [Google Scholar] [CrossRef]
Chauss, D.; Freiwald, T.; McGregor, R.; Yan, B.; Wang, L.; Nova-Lamperti, E.; Kumar, D.; Zhang, Z.; Teague, H.; West, E.E.; et al. Autocrine vitamin D signaling switches off pro-inflammatory programs of TH1 cells. Nat. Immunol. 2021, 23, 62–74. [Google Scholar] [CrossRef]
Donati, S.; Palmini, G.; Aurilia, C.; Falsetti, I.; Miglietta, F.; Iantomasi, T.; Brandi, M.L. Rapid Nontranscriptional Effects of Calcifediol and Calcitriol. Nutrients 2022, 14, 1291. [Google Scholar] [CrossRef]
Mentella, M.C.; Scaldaferri, F.; Pizzoferrato, M.; Gasbarrini, A.; Miggiano, G.A.D. Nutrition, IBD and Gut Microbiota: A Review. Nutrients 2020, 12, 944. [Google Scholar] [CrossRef]
Quintero-Fabián, S.; Bandala, C.; Pichardo-Macías, L.A.; Contreras-García, I.J.; Gómez-Manzo, S.; Hernández-Ochoa, B.; Martínez-Orozco, J.A.; Mejía, I.I.; Cárdenas-Rodríguez, N. Vitamin D and its possible relationship to neuroprotection in COVID-19: Evidence in the literature. Curr. Top. Med. Chem. 2022. [Google Scholar] [CrossRef]
Quraishi, S.A.; Bittner, E.A.; Blum, L.; McCarthy, C.M.; Bhan, I.; Camargo, C.A., Jr. Prospective Study of Vitamin D Status at Initiation of Care in Critically Ill Surgical Patients and Risk of 90-Day Mortality. Crit. Care Med. 2014, 42, 1365–1371. [Google Scholar] [CrossRef]
Cho, D.H.; Lee, G.Y.; An, J.H.; Han, S.N. The effects of 1,25(OH)2 D3 treatment on immune responses and intracellular met-abolic pathways of bone marrow-derived dendritic cells from lean and obese mice. IUBMB Life 2021, 74, 378–390. [Google Scholar] [CrossRef] [PubMed]
He, J.; Li, Y.; Li, H.; Zhang, C.; Zhang, J.; Sun, X.; Zheng, S. Correlation between serum 25-(OH)D3 level and immune imbal-ance of Th1/Th2 cytokines in patients with Hashimoto’s thyroiditis and its effect on autophagy of human Hashimoto thyroid cells. Exp. Ther. Med. 2021, 21, 458. [Google Scholar] [CrossRef] [PubMed]
Jaime, J.; Vargas-Bermúdez, D.; Yitbarek, A.; Reyes, J.; Rodríguez-Lecompte, J. Differential immunomodulatory effect of vitamin D (1,25 (OH)2 D3) on the innate immune response in different types of cells infected in vitro with infectious bursal disease virus. Poult. Sci. 2020, 99, 4265–4277. [Google Scholar] [CrossRef] [PubMed]
Martineau, A.R.; Jolliffe, D.A.; Hooper, R.L.; Greenberg, L.; Aloia, J.F.; Bergman, P.; Dubnov-Raz, G.; Esposito, S.; Ganmaa, D.; Ginde, A.A.; et al. Vitamin D supplementation to prevent acute respiratory tract infections: Systematic review and meta-analysis of individual participant data. BMJ 2017, 356, i6583. [Google Scholar] [CrossRef]
Augustine, L.F.; Nair, K.M.; Kulkarni, B. Sun exposure as a strategy for acquiring vitamin D in developing countries of tropi-cal region: Challenges & way forward. Indian J. Med. Res. 2021, 154, 423–432. [Google Scholar]
Tomaszewska, A.; Rustecka, A.; Lipińska-Opałka, A.; Piprek, R.P.; Kloc, M.; Kalicki, B.; Kubiak, J.Z. The Role of Vitamin D in COVID-19 and the Impact of Pandemic Restrictions on Vitamin D Blood Content. Front. Pharmacol. 2022, 13, 836738. [Google Scholar] [CrossRef]
Sobczyk, M.K.; Gaunt, T.R. The effect of circulating zinc, selenium, copper and vitamin K1 on COVID-19 Outcomes: A Mendelian Randomization Study. Nutrients 2022, 14, 233. [Google Scholar] [CrossRef]
Zendehdel, A.; Ansari, M.; Khatami, F.; Mansoursamaei, S.; Dialameh, H. The effect of vitamin D supplementation on the progression of benign prostatic hyperplasia: A randomized controlled trial. Clin. Nutr. 2021, 40, 3325–3331. [Google Scholar] [CrossRef]
Dai, Q.; Zhu, X.; Manson, J.E.; Song, Y.; Li, X.; Franke, A.A.; Costello, R.B.; Rosanoff, A.; Nian, H.; Fan, L.; et al. Magnesium status and supplementation influence vitamin D status and metabo-lism: Results from a randomised trial. Am. J. Clin. Nutr. 2018, 108, 1249–1258. [Google Scholar] [CrossRef]
Tian, J.; Tang, L.; Liu, X.; Li, Y.; Chen, J.; Huang, W.; Liu, M. Populations in low-magnesium areas were associated with higher risk of infection in COVID-19’s early transmission: A nationwide retrospective cohortatudy in the United States. Nutrients 2022, 14, 909. [Google Scholar] [CrossRef]
Tomasa-Irriguible, T.-M.; Bielsa-Berrocal, L.; Bordejé-Laguna, L.; Tural-Llàcher, C.; Barallat, J.; Manresa-Domínguez, J.-M.; Torán-Monserrat, P. Low Levels of Few Micronutrients May Impact COVID-19 Disease Progression: An Observational Study on the First Wave. Metabolites 2021, 11, 565. [Google Scholar] [CrossRef] [PubMed]
Gaksch, M.; Jorde, R.; Grimnes, G.; Joakimsen, R.; Schirmer, H.; Wilsgaard, T.; Mathiesen, E.B.; Njolstad, I.; Lochen, M.L.; Marz, W.; et al. Vitamin D and mortality: Individual participant data meta-analysis of standardised 25-hydroxyvitamin D in 26916 individuals from a European consortium. PLoS ONE 2017, 12, e0170791. [Google Scholar] [CrossRef] [PubMed]
Griffin, G.; Hewison, M.; Hopkin, J.; Kenny, R.; Quinton, R.; Rhodes, J.; Subramanian, S.; Thickett, D. Vitamin D and COVID-19: Evidence and recommendations for supplementation. R. Soc. Open Sci. 2020, 7, 201912. [Google Scholar] [CrossRef] [PubMed]
Brożyna, A.A.; Jochymski, C.; Janjetovic, Z.; Jóźwicki, W.; Tuckey, R.C.; Slominski, A.T. CYP24A1 expression inversely corre-lates with melanoma progression: Clinic-pathological studies. Int. J. Mol. Sci. 2014, 15, 19000–19017. [Google Scholar] [CrossRef] [PubMed]
Sun, H.; Jiang, C.; Cong, L.; Wu, N.; Wang, X.; Hao, M.; Liu, T.; Wang, L.; Liu, Y.; Cong, X. CYP24A1 inhibition facilitates the an-tiproliferative effect of downregulation of the WNT/beta-Catenin pathway and methylation-mediated regulation of CYP24A1 in colorectal cancer cells. DNA Cell. Biol. 2018, 37, 742–749. [Google Scholar] [CrossRef] [PubMed]
Brustad, N.; Yousef, S.; Stokholm, J.; Bønnelykke, K.; Bisgaard, H.; Chawes, B.L. Safety of high-dose vitamin D supplementa-tion among children aged 0 to 6 years A systematic review and meta-analysis. JAMA 2022, 5, e227410. [Google Scholar]
Amon, U.; Yaguboglu, R.; Ennis, M.; Holick, M.F.; Amon, J. Safety Data in Patients with Autoimmune Diseases during Treatment with High Doses of Vitamin D3 According to the “Coimbra Protocol”. Nutrients 2022, 14, 1575. [Google Scholar] [CrossRef]
Vieth, R. How to optimise vitamin D supplementation to prevent cancer, based on cellular adaptation and hydroxylase en-zymology. Anticancer Res. 2009, 29, 3675–3684. [Google Scholar]
Vicchio, D.; Yergey, A.; O’Brien, K.; Allen, L.; Ray, R.; Holick, M. Quantification and kinetics of 25-hydroxyvitamin D3 by isotope dilution liquid chromatography/thermospray mass spectrometry. Biol. Mass Spectrom. 1993, 22, 53–58. [Google Scholar] [CrossRef]
Kennedy, D.A.; Cooley, K.; Skidmore, B.; Fritz, H.; Campbell, T.; Seely, D. Vitamin D: Pharmacokinetics and Safety When Used in Conjunction with the Pharmaceutical Drugs Used in Cancer Patients: A Systematic Review. Cancers 2013, 5, 255–280. [Google Scholar] [CrossRef]
Melnick, S.; Abaroa-Salvatierra, A.; Deshmukh, M.; Patel, A. Calcitriol mediated hypercalcaemia with silicone granulomas due to cosmetic injection. BMJ Case Rep. 2016, 2016. [Google Scholar] [CrossRef] [PubMed]
Corden, E.; Higgins, E.; Smith, C. Hypercalcaemia-induced kidney injury caused by the vitamin D analogue calcitriol for pso-riasis: A note of caution when prescribing topical treatment. Clin. Exp. Dermatol. 2016, 41, 899–901. [Google Scholar] [CrossRef] [PubMed]
Liu, P.T.; Stenger, S.; Li, H.; Wenzel, L.; Tan, B.H.; Krutzik, S.R.; Ochoa, M.T.; Schauber, J.; Wu, K.; Meinken, C.; et al. Toll-like receptor triggering of a vitamin D-mediated human anti-microbial response. Science 2006, 311, 1770–1773. [Google Scholar] [CrossRef] [PubMed]
Kaufman, H.W.; Niles, J.K.; Kroll, M.H.; Bi, C.; Holick, M.F. SARS-CoV-2 positivity rates associated with circu-lating 25-hydroxyvitamin D levels. PLoS ONE 2020, 15, e0239252. [Google Scholar] [CrossRef]
Dror, A.A.; Morozov, N.; Daoud, A.; Namir, Y.; Yakir, O.; Shachar, Y.; Lifshitz, M.; Segal, E.; Fisher, L.; Mizrachi, M.; et al. Pre-infection 25-hydroxyvitamin D3 levels and association with severity of COVID-19 illness. PLoS ONE 2022, 17, e0263069. [Google Scholar] [CrossRef]
Wimalawansa, S.J. Global epidemic of coronavirus—COVID-19: What can we do to minimize risks? Eur. J. Biomed. Pharm. Sci. 2020, 7, 432–438. [Google Scholar]
Chambers, E.S.; Hawrylowicz, C.M. The Impact of Vitamin D on Regulatory T Cells. Curr. Allergy Asthma Rep. 2010, 11, 29–36. [Google Scholar] [CrossRef]
Alexander, J.; Tinkov, A.; Strand, T.A.; Alehagen, U.; Skalny, A.; Aaseth, J. Early nutritional interventions with zinc, selenium and vitamin D for raising antiviral resistance against progressive COVID-19. Nutrients 2020, 12, 2358. [Google Scholar] [CrossRef]
Bakaloudi, D.R.; Chourdakis, M. A critical update on the role of mild and serious vitamin D deficiency prevalence and the COVID-19 epidemic in Europe. Nutrition 2021, 93, 111441. [Google Scholar] [CrossRef]
Akbari, A.R.; Khan, M.; Adeboye, W.; Lee, L.H.H.; Chowdhury, S.I. Ethnicity as a risk factor for vitamin D deficiency and undesirable COVID-19 outcomes. Rev. Med. Virol. 2021, 32, e2291. [Google Scholar] [CrossRef]
Ioannou, G.N.; Locke, E.R.; O’Hare, A.M.; Bohnert, A.S.B.; Boyko, E.J.; Hynes, D.M.; Berry, K. COVID-19 Vaccination Effectiveness Against Infection or Death in a National U.S. Health Care System: A Target Trial Emulation Study. Ann. Intern. Med. 2022, 175, 352–361. [Google Scholar] [CrossRef] [PubMed]
Regev-Yochay, R.; Gonen, T.; Gilboa, M.; Mandelboim, M.; Indenbaum, V.; Amit, S.; Meltzer, L.; Asraf, K.; Cohen, C.; Fluss, R.; et al. 4th Dose COVID mRNA Vaccines’ Immunogenicity & Efficacy against Omicron VOC. 2022. Available online: https://www.medrxiv.org/content/10.1101/2022.02.15.22270948v1 (accessed on 4 May 2022).
Seneff, S.; Nigh, G.; Kyriakopoulos, A.M.; McCullough, P.A. Innate immune suppression by SARS-CoV-2 mRNA vaccinations: The role of G-quadruplexes, exosomes, and MicroRNAs. Food Chem. Toxicol. 2022, 164, 113008. [Google Scholar] [CrossRef] [PubMed]
DiNicolantonio, J.J.; O’Keefe, J.H. Magnesium and Vitamin D Deficiency as a Potential Cause of Immune Dysfunction, Cyto-kine Storm and Disseminated Intravascular Coagulation in COVID-19 patients. Mo. Med. 2021, 118, 68–73. [Google Scholar] [PubMed]
Vanegas-Cedillo, P.E.; Bello-Chavola, O.Y.; Ramirez-Pedraza, N.; Encinas, B.R.; Perez Carrion, C.I.; Jasso-Avila, M.I.; Valladares-Garcia, J.C.; Hernandez-Juarez, D.; Vanegas-Cedillo, P.E.; Vargas-Vazquez, A.; et al. Serum Vitamin D Levels Are Associated With Increased COVID-19 Severity and Mortality Inde-pendent of Whole-Body and Visceral Adiposity. Front. Nutr. 2022, 9, 813485. [Google Scholar] [CrossRef]
Kumar, P.; Kumar, M.; Bedi, O.; Gupta, M.; Kumar, S.; Jaiswal, G.; Rahi, V.; Yedke, N.G.; Bijalwan, A.; Sharma, S.; et al. Role of vitamins and minerals as immunity boosters in COVID-19. Inflammopharmacology 2021, 29, 1001–1016. [Google Scholar] [CrossRef]
Kumar, R.; Rathi, H.; Haq, A.; Wimalawansa, S.J.; Sharma, A. Putative roles of vitamin D in modulating immune response and immunopathology associated with COVID-19. Virus Res. 2020, 292, 198235. [Google Scholar] [CrossRef]
Bae, J.H.; Choe, H.J.; Holick, M.F.; Lim, S. Association of vitamin D status with COVID-19 and its severity: Vitamin D and COVID-19: A narrative review. Rev. Endocr. Metab. Disord. 2022, 23, 579–599. [Google Scholar] [CrossRef]
Bushnaq, T.; Algethami, F.; Qadhi, A.; Mustafa, R.; Ghafouri, K.; Azhar, W.; Malki, A.A. The impact of vitamin D status on COVID-19 severity among hospitalised patients in the western region of Saudi Arabia: A retrospective cross-sectional study. Int. J. Environ. Res. Public Health 2022, 19, 1901. [Google Scholar] [CrossRef]
Kazemi, A.; Mohammadi, V.; Aghababaee, S.A.; Golzarand, M.; Clark, C.C.T.; Babajafari, S. Association of vitamin D status with SARS-CoV-2 infection or COVID-19 severity: A systematic review and meta-analysis. Adv. Nutr. 2021, 12, 1636–1658. [Google Scholar] [CrossRef]
Borsche, L.; Glauner, B.; von Mendel, J. COVID-19 Mortality Risk Correlates Inversely with Vitamin D3 Status, and a Mortal-ity Rate Close to Zero Could Theoretically Be Achieved at 50 ng/mL 25(OH)D3: Results of a Systematic Review and Meta-Analysis. Nutrients 2021, 13, 3596. [Google Scholar] [CrossRef]
Wimalawansa, S.J. Controlling COVID-19 pandemic with cholecalciferol. World J. Adv. Heathc. Res. 2020, 5, 155–165. [Google Scholar]
Wimalawansa, S.J. Oral Calcifediol Repletes Blood Vitamin D Concentration within 4 Hours. Available online: https://www.linkedin.com/posts/sunilwimalawansa_oral-calcifediol-repletes-blood-vitamin-activity-6803351558714204160-dtnd (accessed on 25 May 2022).
Bikle, D.D.; Schwartz, J. Vitamin D binding protein, total and free vitamin D levels in different physiological and pathophys-iological conditions. Front. Endocrinol. 2019, 10, 317. [Google Scholar] [CrossRef] [PubMed]
Nagai, J.; Sato, K.; Yumoto, R.; Takano, M. Megalin/Cubilin-mediated Uptake of FITC-labeled IgG by OK Kidney Epithelial Cells. Drug Metab. Pharmacokinet. 2011, 26, 474–485. [Google Scholar] [CrossRef] [PubMed]
Cashman, K.D.; Ritz, C.; Carlin, A.; Kennedy, M. Vitamin D biomarkers for Dietary Reference Intake development in children: A systematic review and meta-analysis. Am. J. Clin. Nutr. 2022, 115, 544–558. [Google Scholar] [CrossRef]
Cashman, K.D.; Fitzgerald, A.P.; Viljakainen, H.T.; Jakobsen, J.; Michaelsen, K.F.; Lamberg-Allardt, C.; Mølgaard, C. Estimation of the dietary requirement for vitamin D in healthy adolescent white girls. Am. J. Clin. Nutr. 2011, 93, 549–555. [Google Scholar] [CrossRef]
Wimalawansa, S.J.; Polonowita, A. Boosting Immunity with Vitamin D for Preventing Complications and Deaths from COVID-19. In COVID 19: Impact, Mitigation, Opportunities and Building Resilience “From Adversity to Serendipity”, Perspectives of Global Relevance Based on Research, Experience and Successes in Combating COVID-19 in Sri Lanka; National Science Foundation of Sri Lanka: Colombo, Sri Lanka, 2021. [Google Scholar]
Hribar, C.A.; Cobbold, P.H.; Church, F.C. Potential Role of Vitamin D in the Elderly to Resist COVID-19 and to Slow Progression of Parkinson’s Disease. Brain Sci. 2020, 10, 284. [Google Scholar] [CrossRef]
AlSafar, H.; Grant, W.B.; Hijazi, R.; Uddin, M.; Alkaabi, N.; Tay, G.; Mahboub, B.; Al Anouti, F. COVID-19 Disease Severity and Death in Relation to Vitamin D Status among SARS-CoV-2-Positive UAE Residents. Nutrients 2021, 13, 1714. [Google Scholar] [CrossRef]
Grant, W.B.; Lahore, H.; McDonnell, S.L.; Baggerly, C.A.; French, C.B.; Aliano, J.L.; Bhattoa, H.P. Evidence that Vitamin D Supplementation Could Reduce Risk of Influenza and COVID-19 Infections and Deaths. Nutrients 2020, 12, 988. [Google Scholar] [CrossRef]
Boucher, B.J. The problems of vitamin d insufficiency in older people. Aging Dis. 2012, 3, 313–329. [Google Scholar]
Sabetta, J.R.; DePetrillo, P.; Cipriani, R.J.; Smardin, J.; Burns, L.A.; Landry, M.L. Serum 25-hydroxyvitamin d and the inci-dence of acute viral respiratory tract infections in healthy adults. PLoS ONE 2010, 5, e11088. [Google Scholar] [CrossRef]
Molloy, E.J.; Murphy, N. Vitamin D, COVID-19 and Children. Ir. Med. J. 2020, 113, 64. [Google Scholar] [PubMed]
Shiravi, A.A.; Saadatkish, M.; Abdollahi, Z.; Miar, P.; Khanahmad, H.; Zeinalian, M. Vitamin D can be effective on the prevention of COVID-19 complications: A narrative review on molecu-lar aspects. Int. J. Vitam. Nutr. Res. 2020, 92, 1–13. [Google Scholar] [CrossRef] [PubMed]
Stohs, S.J.; Aruoma, O.I. Vitamin D and Wellbeing beyond Infections: COVID-19 and Future Pandemics. J. Am. Coll. Nutr. 2020, 40, 41–42. [Google Scholar] [CrossRef]
Garg, M.; Al-Ani, A.H.; Mitchell, H.; Hendy, P.; Christensen, B. Editorial: Low population mortality from COVID-19 in countries south of latitude 35 degrees North-supports vitamin D as a factor determining severity. Authors’ reply. Aliment. Pharmacol. Ther. 2020, 51, 1438–1439. [Google Scholar] [CrossRef] [PubMed]
Nogues, X.; Ovejero, D.; Pineda-Moncusí, M.; Bouillon, R.; Arenas, D.; Pascual, J.; Ribes, A.; Guerri-Fernandez, R.; Villar-Garcia, J.; Rial, A.; et al. Calcifediol Treatment and COVID-19–Related Outcomes. J. Clin. Endocrinol. Metab. 2021, 106, e4017–e4027. [Google Scholar] [CrossRef] [PubMed]
Castillo, M.E.; Costa, L.M.E.; Barrios, J.M.V.; Diaz, J.F.A.; Miranda, J.L.; Bouillon, R.; Gomez, J.M.Q. Effect of calcifediol treatment and best available therapy versus best available therapy on intensive care unit admission and mortality among pa-tients hospitalised for COVID-19: A pilot randomised clinical study. J. Steroid Biochem. Mol. Biol. 2020, 203, 105751. [Google Scholar]
Tuncay, M.E.; Gemcioglu, E.; Kayaaslan, B.; Ates, I.; Guner, R.; Eser, F.; Hasanoglu, I.; Kalem, A.K.; Aypak, A.; Agac, Z.S.; et al. A notable key for estimating the severity of COVID-19: 25-hydroxyvitamin D status. Turk. J. Biochem. 2021, 46, 167–172. [Google Scholar] [CrossRef]
Alcala-Diaz, J.F.; Limia-Perez, L.; Gomez-Huelgas, R.; Martin-Escalante, M.D.; Cortes-Rodriguez, B.; Zambrana-Garcia, J.L.; Entrenas-Castillo, M.; Perez-Caballero, A.I.; López-Carmona, M.D.; Garcia-Alegria, J.; et al. Calcifediol treatment and hospital mortality due to COVID-19: A cohort study. Nutrients 2021, 13, 1760. [Google Scholar] [CrossRef]
Quraishi, S.A.; De Pascale, G.; Needleman, J.S.; Nakazawa, H.; Kaneki, M.; Bajwa, E.K.; Camargo, C.A., Jr.; Bhan, I. Effect of Cholecalciferol Supplementation on Vitamin D Status and Cathelicidin Levels in Sepsis: A Ran-domised, Placebo-Controlled Trial. Crit. Care Med. 2015, 43, 1928–1937. [Google Scholar] [CrossRef]
Holick, M.F. Vitamin D Status: Measurement, Interpretation, and Clinical Application. Ann. Epidemiol. 2009, 19, 73–78. [Google Scholar] [CrossRef]
D’Avolio, A.; Avataneo, V.; Manca, A.; Cusato, J.; De Nicolò, A.; Lucchini, R.; Keller, F.; Cantù, M. 25-Hydroxyvitamin D Concentrations Are Lower in Patients with Positive PCR for SARS-CoV-2. Nutrients 2020, 12, 1359. [Google Scholar] [CrossRef] [PubMed]
Pereira, M.; Dantas Damascena, A.; Galvão Azevedo, L.M.; de Almeida Oliveira, T.; da Mota Santana, J. Vitamin D deficiency aggravates COVID-19: Systematic review and meta-analysis. Crit. Rev. Food Sci. Nutr. 2022, 62, 1308–1316. [Google Scholar] [CrossRef] [PubMed]
Annweiler, G.; Corvaisier, M.; Gautier, J.; Dubée, V.; Legrand, E.; Sacco, G.; Annweiler, C.; on behalf of the GERIA-COVID study group. Vitamin D Supplementation Associated to Better Survival in Hospitalized Frail Elderly COVID-19 Patients: The GERIA-COVID Quasi-Experimental Study. Nutrients 2020, 12, 3377. [Google Scholar] [CrossRef] [PubMed]
Maghbooli, Z.; Sahraian, M.A.; Ebrahimi, M.; Pazoki, M.; Kafan, S.; Tabriz, H.M.; Hadadi, A.; Montazeri, M.; Nasiri, M.; Shirvani, A.; et al. Vitamin D sufficiency, a serum 25-hydroxyvitamin D at least 30 ng/mL reduced risk for adverse clinical outcomes in patients with COVID-19 infection. PLoS ONE 2020, 15, e0239799. [Google Scholar] [CrossRef] [PubMed]
Vink, M.; Vink-Niese, A. Could Cognitive Behavioural Therapy Be an Effective Treatment for Long COVID and Post COVID-19 Fatigue Syndrome? Lessons from the Qure Study for Q-Fever Fatigue Syndrome. Healthcare 2020, 8, 552. [Google Scholar] [CrossRef]
Murai, I.H.; Fernandes, A.L.; Sales, L.P.; Pinto, A.J.; Goessler, K.F.; Duran, C.S.C.; Silva, C.B.R.; Franco, A.S.; Macedo, M.B.; Dalmolin, M.H.H.; et al. Effect of a single high dose of vitamin D3 on hospital length of stay in patients with moderate to severe COVID-19: A randomised clinical trial. JAMA 2021, 325, 1053–1060. [Google Scholar] [CrossRef]
Boucher, B.J. Why do so many trials of vitamin D supplementation fail? Endocr. Connect. 2020, 9, R195–R206. [Google Scholar] [CrossRef]
Wimalawansa, S.J. Significance of plasma PTH-rp in patients with hypercalcemia of malignancy treated with bisphospho-nate. Cancer 1994, 73, 2223–2230. [Google Scholar] [CrossRef]
Cooper, C.; Li, H.; Wimalawansa, S.J. Cancer-associated hypercalcemia and parathyroid hormone-related peptide: A new peptide with diverse roles. Reg. Pept. Lett. 1997, 7, 39–42. [Google Scholar]
Azer, S.M.; E Vaughan, L.; Tebben, P.J.; Sas, D.J. 24-Hydroxylase Deficiency Due to CYP24A1 Sequence variants: Compari-son with other vitamin D-mediated hypercalcemia disorders. J. Endocr. Soc. 2021, 5, bvab119. [Google Scholar] [CrossRef]
Jayaraj, J.M.; Kuriakose, B.B.; Alhazmi, A.H.; Muthusamy, K. Structural and functional insights on vitamin D receptor and CYP24A1 deleterious single nucleotide pol-ymorphisms: A computational and pharmacogenomics perpetual approach. Cell. Biochem. Funct. 2021, 39, 874–885. [Google Scholar] [CrossRef]
McDonnell, S.L.; Baggerly, C.A.; French, C.B.; Baggerly, L.L.; Garland, C.F.; Gorham, E.D.; Hollis, B.W.; Trump, D.L.; Lappe, J.M. Breast cancer risk markedly lower with serum 25-hydroxyvitamin D concentrations >/=60 vs. < 20 ng/ml (150 vs. 50 nmol/L): Pooled analysis of two randomised trials and a prospective cohort. PLoS ONE 2018, 13, e0199265. [Google Scholar] [CrossRef] [PubMed]
Davies, M. High-dose vitamin D therapy: Indications, benefits and hazards. Int. J. Vitam. Nutr. Res. Suppl. 1989, 30, 81–86. [Google Scholar] [PubMed]
Kimball, S.M.; Mirhosseini, N.; Holick, M.F. Evaluation of vitamin D3 intakes up to 15,000 international units/day and serum 25-hydroxyvitamin D concentrations up to 300 nmol/L on calcium metabolism in a community setting. Dermato-Endocrinology 2017, 9, e1300213. [Google Scholar] [CrossRef]
McCullough, P.J.; Lehrer, D.S.; Amend, J. Daily oral dosing of vitamin D3 using 5000 TO 50,000 international units a day in long-term hospitalised patients: Insights from a seven year experience. J. Steroid. Biochem. Mol. Biol. 2019, 189, 228–239. [Google Scholar] [CrossRef]
Vieth, R. Vitamin D toxicity, policy, and science. J. Bone Miner. Res. 2007, 22 (Suppl. S2), V64–V68. [Google Scholar] [CrossRef]
Holick, M.F.; Binkley, N.C.; Bischoff-Ferrari, H.A.; Gordon, C.M.; Hanley, D.A.; Heaney, R.P.; Murad, M.H.; Weaver, C.M.; Endocrine Society. Evaluation, Treatment, and Prevention of Vitamin D Deficiency: An Endocrine Society Clinical Practice Guideline. J. Clin. Endocrinol. Metab. 2011, 96, 1911–1930. [Google Scholar] [CrossRef] [PubMed]
Jorde, R.; Sollid, S.T.; Svartberg, J.; Schirmer, H.; Joakimsen, R.M.; Njølstad, I.; Fuskevåg, O.M.; Figenschau, Y.; Hutchinson, M.Y. Vitamin D 20 000 IU per Week for Five Years Does Not Prevent Progression From Prediabetes to Diabetes. J. Clin. Endocrinol. Metab. 2016, 101, 1647–1655. [Google Scholar] [CrossRef]
Quesada-Gomez, J.M.; Bouillon, R. Is calcifediol better than cholecalciferol for vitamin D supplementation? Osteoporos. Int. 2018, 29, 1697–1711. [Google Scholar] [CrossRef]
Brancatella, A.; Cappellani, D.; Vignali, E.; Canale, D.; Marcocci, C. Calcifediol Rather Than Cholecalciferol for a Patient Submitted to Malabsortive Bariatric Surgery: A Case Report. J. Endocr. Soc. 2017, 1, 1079–1084. [Google Scholar] [CrossRef]
Hurst, S.D.; Muchamuel, T.; Gorman, D.M.; Gilbert, J.M.; Clifford, T.; Kwan, S.; Menon, S.; Seymour, B.; Jackson, C.; Kung, T.T.; et al. New IL-17 family members promote Th1 or Th2 responses in the lung: In vivo function of the novel cyto-kine IL-25. J. Immunol. 2002, 169, 443–453. [Google Scholar]
Gorman, S.; Tan, D.H.; Lambert, M.J.; Scott, N.M.; Judge, M.A.; Hart, P.H. Vitamin D(3) deficiency enhances allergen-induced lymphocyte responses in a mouse model of allergic air-way disease. Pediatr. Allergy Immunol. 2012, 23, 83–87. [Google Scholar]
Matos, C.; Renner, K.; Peuker, A.; Schoenhammer, G.; Schreiber, L.; Bruss, C.; Eder, R.; Bruns, H.; Flamann, C.; Hoffmann, P.; et al. Physiological levels of 25-hydroxyvitamin D3 induce a suppressive CD4(+) T cell phenotype not reflected in the epigenetic landscape. Scand. J. Immunol. 2022, 95, e13146. [Google Scholar] [CrossRef]
Rodriguez-Lecompte, J.C.; Yitbarek, A.; Cuperus, T.; Echeverry, H.; van Dijk, A. The immunomodulatory effect of vitamin D in chickens is dose-dependent and influenced by calcium and phosphorus levels. Poult. Sci. 2016, 95, 2547–2556. [Google Scholar] [CrossRef]
Ahmed, F. A Network-Based Analysis Reveals the Mechanism Underlying Vitamin D in Suppressing Cytokine Storm and Virus in SARS-CoV-2 Infection. Front. Immunol. 2020, 11, 590459. [Google Scholar] [CrossRef] [PubMed]
Fiske, C.T.; Blackman, A.; Maruri, F.; Rebeiro, P.F.; Huaman, M.; Kator, J.; Algood, H.M.S.; Sterling, T.R. Increased vitamin D receptor expression from macrophages after stimulation with M. tuberculosis among persons who have recovered from extrapulmonary tuberculosis. BMC Infect. Dis. 2019, 19, 366. [Google Scholar] [CrossRef]
US Department of Agriculture, Agricultural Research Service. USDA Nutrient Database for Standard Reference. Release. Available online: http://www.nal.usda.gov/fnic/foodcomp/search/ (accessed on 4 May 2022).
Wimalawansa, S.J. Vitamin D Deficiency: Effects on Oxidative Stress, Epigenetics, Gene Regulation, and Aging. Biology 2019, 8, 30. [Google Scholar] [CrossRef]
Chambers, P.W. COVID-19, ARDS, ACOVCS, MIS-C, KD, PMIS, TSS, MIS-A: Connecting the Alphabet? Clin. Med. 2020, 2, 1027. [Google Scholar] [CrossRef]
Onalan, E.; Bozkurt, A.; Gursu, M.F.; Yakar, B.; Donder, E. Role of Betatrophin and Inflammation Markers in Type 2 Diabetes Mellitus, Prediabetes and Metabolic Syndrome. J. Coll. Phys. Surg. Pak. 2022, 32, 303–307. [Google Scholar] [CrossRef]
Aatsinki, S.-M.; Elkhwanky, M.-S.; Kummu, O.; Karpale, M.; Buler, M.; Viitala, P.; Rinne, V.; Mutikainen, M.; Tavi, P.; Franko, A.; et al. Fasting-Induced Transcription Factors Repress Vitamin D Bioactivation, a Mechanism for Vitamin D Deficiency in Diabetes. Diabetes 2019, 68, 918–931. [Google Scholar] [CrossRef]
Galassetti, P. Inflammation and Oxidative Stress in Obesity, Metabolic Syndrome, and Diabetes. Exp. Diabetes Res. 2012, 2012, 943706. [Google Scholar] [CrossRef] [PubMed]
Wang, W.; Zhang, J.; Wang, H.; Wang, X.; Liu, S. Vitamin D deficiency enhances insulin resistance by promoting inflammation in type 2 diabetes. Int. J. Clin. Exp. Pathol. 2019, 12, 1859–1867. [Google Scholar] [PubMed]
Askari, G.; Foroughi, M.; Maghsoudi, Z. The effect of vitamin D supplementation on blood sugar and different indices of insulin resistance in patients with non-alcoholic fatty liver disease (NAFLD). Iran. J. Nurs. Midwifery Res. 2016, 21, 100–104. [Google Scholar] [CrossRef] [PubMed]
Karonova, T.; Stepanova, A.; Bystrova, A.; Jude, E.B. High-Dose Vitamin D Supplementation Improves Microcirculation and Reduces Inflammation in Diabetic Neuropathy Patients. Nutrients 2020, 12, 2518. [Google Scholar] [CrossRef]
Elkhwanky, M.; Kummu, O.; Piltonen, T.T.; Laru, J.; Morin-Papunen, L.; Mutikainen, M.; Tavi, P.; Hakkola, J. Obesity Represses CYP2R1, the Vitamin D 25-Hydroxylase, in the Liver and Extrahepatic Tissues. JBMR Plus 2020, 4, e10397. [Google Scholar] [CrossRef]
Roizen, J.D.; Long, C.; Casella, A.; O’Lear, L.; Caplan, I.; Lai, M.; Sasson, I.; Singh, R.; Makowski, A.J.; Simmons, R.; et al. Obesity Decreases Hepatic 25-Hydroxylase Activity Causing Low Serum 25-Hydroxyvitamin D. J. Bone Miner. Res. 2019, 34, 1068–1073. [Google Scholar] [CrossRef]
Wimalawansa, S.J. Fighting against COVID-19: Boosting the immunity with micronutrients, stress reduction, physical activi-ty, and vitamin D. Nutr. Food Sci. J. 2020, 3, 126. [Google Scholar]
Wimalawansa, S.J. Vitamin D and cardiovascular diseases: Causality. J. Steroid Biochem. Mol. Biol. 2018, 175, 29–43. [Google Scholar] [CrossRef]
Giusti, A.; Barone, A.; Pioli, G.; Girasole, G.; Razzano, M.; Pizzonia, M.; Pedrazzoni, M.; Palummeri, E.; Bianchi, G. Heterogeneity in serum 25-hydroxy-vitamin D response to cholecalciferol in elderly women with secondary hyperparathyroidism and vitamin D deficiency. J. Am. Geriatr. Soc. 2010, 58, 1489–1495. [Google Scholar] [CrossRef]
Bacon, C.J.; Gamble, G.D.; Horne, A.M.; Scott, M.A.; Reid, I.R. High-dose oral vitamin D3 supplementation in the elderly. Osteoporos. Int. 2008, 20, 1407–1415. [Google Scholar] [CrossRef]
LeBlanc, E.S.; Pratley, R.E.; Dawson-Hughes, B.; Staten, M.A.; Sheehan, P.R.; Lewis, M.R.; Peters, A.; Kim, S.H.; Chatterjee, R.; Aroda, V.R.; et al. Baseline Characteristics of the Vitamin D and Type 2 Diabetes (D2d) Study: A Contemporary Prediabetes Cohort That Will Inform Diabetes Prevention Efforts. Diabetes Care 2018, 41, 1590–1599. [Google Scholar] [CrossRef] [PubMed]
Dawson-Hughes, B.; Staten, M.A.; Knowler, W.C.; Nelson, J.; Vickery, E.M.; LeBlanc, E.S.; Neff, L.M.; Park, J.; Pittas, A.G. Intratrial Exposure to Vitamin D and New-Onset Diabetes Among Adults With Prediabetes: A Secondary Analysis From the Vitamin D and Type 2 Diabetes (D2d) Study. Diabetes Care 2020, 43, 2916–2922. [Google Scholar] [CrossRef] [PubMed]
El Sabeh, M.; Ghanem, P.; Al-Shaar, L.; Rahme, M.; Baddoura, R.; Halaby, G.; Singh, R.J.; Vanderschueren, D.; Bouillon, R.; El-Hajj Fuleihan, G. Total, Bioavailable, and Free 25(OH)D Relationship with Indices of Bone Health in Elderly: A Randomized Controlled Trial. J. Clin. Endocrinol. Metab. 2021, 106, e990–e1001. [Google Scholar] [CrossRef] [PubMed]
Srikanth, P.; Chun, R.F.; Hewison, M.; Adams, J.S.; Bouillon, R.; Vanderschueren, D.; Lane, N.; Cawthon, P.M.; Dam, T.; Barrett-Connor, E.; et al. Associations of total and free 25OHD and 1,25(OH)2D with serum markers of inflammation in older men. Osteoporos. Int. 2016, 27, 2291–2300. [Google Scholar] [CrossRef]
Bikle, D.; Bouillon, R.; Thadhani, R.; Schoenmakers, I. Vitamin D metabolites in captivity? Should we measure free or total 25(OH)D to assess vitamin D status? J. Steroid Biochem. Mol. Biol. 2017, 173, 105–116. [Google Scholar] [CrossRef]
Schwartz, J.B.; Gallagher, J.C.; Jorde, R.; Berg, V.; Walsh, J.; Eastell, R.; Evans, A.L.; Bowles, S.; Naylor, K.E.; Jones, K.S.; et al. Determination of Free 25(OH)D Concentrations and Their Relationships to Total 25(OH)D in Multiple Clinical Populations. J. Clin. Endocrinol. Metab. 2018, 103, 3278–3288. [Google Scholar] [CrossRef]
Ginde, A.; Brower, R.G.; Caterino, J.M.; Finck, L.; Banner-Goodspeed, V.M.; Grissom, C.K.; Hayden, D.; Hough, C.L.; Hyzy, R.C.; et al.; National Heart, Lung, and Blood Institute PETAL Clinical Trials Network Early High-Dose Vitamin D3 for Critically Ill, Vitamin D-Deficient Patients. N. Engl. J. Med. 2019, 381, 2529–2540. [Google Scholar]
Wimalawansa, S.J. Vitamin D: Everything You Need to Know; Karunaratne & Sons: Homagama, Sri Lanka, 2012; ISBN 978-955-9098-94-2. [Google Scholar]
Wimalawansa, S.J. Clinical Perspective: Effective and practical ways to overcome vitamin D deficiency. Fam. Med. Community Health 2021, 8, 1–8. [Google Scholar]
Abbasnezhad, A.; Amani, R.; Hajiani, E.; Alavinejad, P.; Cheraghian, B.; Ghadiri, A. Effect of Vitamin D on Gastrointestinal Symptoms and Health-Related Quality of Life in Irritable Bowel Syndrome Patients: A Randomized Double-Blind Clinical Trial. Neurogastroenterol. Motil. 2016, 28, 1533–1544. [Google Scholar] [CrossRef]
Yilmaz, R.; Salli, A.; Cingoz, H.T.; Kucuksen, S.; Ugurlu, H. Efficacy of vitamin D replacement therapy on patients with chronic nonspecific widespread musculoskeletal pain with vitamin D deficiency. Int. J. Rheum. Dis. 2016, 19, 1255–1262. [Google Scholar] [CrossRef]
Chrysostomou, S.; Information, R. Vitamin D Daily short-term Supplementation does not Affect Glycemic Outcomes of Patients with Type 2 Diabetes. Int. J. Vitam. Nutr. Res. 2016, 86, 169–183. [Google Scholar] [CrossRef] [PubMed]
Heidari, H.; Amani, R.; Feizi, A.; Askari, G.; Kohan, S.; Tavasoli, P. Vitamin D Supplementation for Premenstrual Syndrome-Related Inflammation and Antioxidant Markers in Students with Vitamin D Deficient: A Randomized Clinical Trial. Sci. Rep. 2019, 9, 14939. [Google Scholar] [CrossRef]
Mehdizadehkashi, A.; Rokhgireh, S.; Tahermanesh, K.; Eslahi, N.; Minaeian, S.; Samimi, M. The effect of vitamin D supple-mentation on clinical symptoms and metabolic profiles in patients with endometriosis. Gynecol. Endocrinol. 2021, 37, 640–645. [Google Scholar] [CrossRef]
Bagheri, S.; Saghazade, A.R.; Abbaszadeh-Mashkani, S.; Banafshe, H.R.; Ghoreishi, F.S.; Mesdaghinia, A.; Ghaderi, A. The effect of vitamin D supplementation on tobacco-related disorders in individuals with a tobacco use disorder: A randomized clinical trial. J. Addict. Dis. 2022, 40, 382–393. [Google Scholar] [CrossRef]
Griffin, G.; Hewison, M.; Hopkin, J.; Kenny, R.A.; Quinton, R.; Rhodes, J.; Subramanian, S.; Thickett, D. Preventing vitamin D deficiency during the COVID-19 pandemic: UK definitions of vitamin D sufficiency and recommended supplement dose are set too low. Clin. Med. 2021, 21, e48–e51. [Google Scholar] [CrossRef] [PubMed]
Bradley, R.; Schloss, J.; Brown, D.; Celis, D.; Finnell, J.; Hedo, R.; Honcharov, V.; Pantuso, T.; Peña, H.; Lauche, R.; et al. The effects of vitamin D on acute viral respiratory infections: A rapid review. Adv. Integr. Med. 2020, 7, 192–202. [Google Scholar] [CrossRef]
Singer, P.; Blaser, A.R.; Berger, M.M.; Alhazzani, W.; Calder, P.C.; Casaer, M.P.; Hiesmayr, M.; Mayer, K.; Montejo, J.C.; Pichard, C.; et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin. Nutr. 2019, 38, 48–79. [Google Scholar] [CrossRef] [PubMed]
Bikle, D.D. Vitamin D metabolism, mechanism of action, and clinical applications. Chem. Biol. 2014, 21, 319–329. [Google Scholar] [CrossRef]
Heaney, R.P. Vitamin D in Health and Disease. Clin. J. Am. Soc. Nephrol. 2008, 3, 1535–1541. [Google Scholar] [CrossRef]
Chun, R.; Liu, P.T.; Modlin, R.L.; Adams, J.S.; Hewison, M. Impact of vitamin D on immune function: Lessons learned from genome-wide analysis. Front. Physiol. 2014, 5, 151. [Google Scholar] [CrossRef]
Aygun, H. Vitamin D can prevent COVID-19 infection-induced multiple organ damage. Naunyn-Schmiedebergs Arch. Exp. Pathol. Pharmakol. 2020, 393, 1157–1160. [Google Scholar] [CrossRef] [PubMed]
Bishop, E.L.; Ismailova, A.; Dimeloe, S.K.; Hewison, M.; White, J.H. Vitamin D and Immune Regulation: Antibacterial, Antiviral, Anti-Inflammatory. JBMR Plus 2020, 5, e10405. [Google Scholar] [CrossRef] [PubMed]
Jeffery, L.E.; Burke, F.; Mura, M.; Zheng, Y.; Qureshi, O.S.; Hewison, M.; Walker, L.S.K.; Lammas, D.A.; Raza, K.; Sansom, D.M. 1,25-Dihydroxyvitamin D3 and IL-2 combine to inhibit T cell production of inflammatory cytokines and promote development of regulatory T cells expressing CTLA-4 and FoxP3. J. Immunol. 2009, 183, 5458–5467. [Google Scholar] [CrossRef] [PubMed]
Bania, A.; Pitsikakis, K.; Mavrovounis, G.; Mermiri, M.; Beltsios, E.T.; Adamou, A.; Konstantaki, V.; Makris, D.; Tsolaki, V.; Gourgoulianis, K.; et al. Therapeutic Vitamin D Supplementation Following COVID-19 Diagnosis: Where Do We Stand?—A Systematic Review. J. Pers. Med. 2022, 12, 419. [Google Scholar] [CrossRef] [PubMed]
D’Ecclesiis, O.; Gavioli, C.; Martinoli, C.; Raimondi, S.; Chiocca, S.; Miccolo, C.; Bossi, P.; Cortinovis, D.; Chiaradonna, F.; Palorini, R.; et al. Vitamin D and SARS-CoV2 infection, severity and mortality: A systematic review and meta-analysis. PLoS ONE 2022, 17, e0268396-10. [Google Scholar] [CrossRef]
Sune Negre, J.M.; Azpitarte, I.O.; Barrios, P.d.A.; Hernández Herrero, G. Calcifediol Soft Capsules. SP Patent WO 2016/124724, 11 August 2016. Available online: https://patents.google.com/patent/WO2016124724A1 (accessed on 4 May 2022).
Petkovich, M.; Melnick, J.; White, J.; Tabash, S.; Strugnell, S.; Bishop, C.W. Modified-release oral calcifediol corrects vitamin D insufficiency with minimal CYP24A1 upregulation. J. Steroid Biochem. Mol. Biol. 2015, 148, 283–289. [Google Scholar] [CrossRef]
Varikasuvu, S.R.; Thangappazham, B.; Vykunta, A.; Duggina, P.; Manne, M.; Raj, H.; Aloori, S. COVID-19 and vitamin D (Co-VIVID study): A systematic review and meta-analysis of randomized controlled trials. Expert Rev. Anti Infect. Ther. 2022, 20, 907–913. [Google Scholar] [CrossRef]
Rhodes, J.M.; Subramanian, S.; Laird, E.; Griffin, G.; Kenny, R.A. Perspective: Vitamin D Deficiency and COVID-19 Severity—Plausibly Linked by Latitude, Ethnicity, Impacts on Cytokines, ACE2, and Thrombosis (R1). J. Intern. Med. 2020, 289, 97–115. [Google Scholar] [CrossRef]
Wimalawansa, S.J. Sri Lanka. J. Diabetes Endocrinol. Metabol. 2012, 1, 73–88. [Google Scholar] [CrossRef]
Wimalawansa, S.J. Achieving population vitamin D sufficiency will markedly reduce healthcare costs. EJBPS 2020, 7, 136–141. [Google Scholar]