Amazon túto knihu donedávna cenzuroval, tak som si povedal, že jej dám trochu viac priestoru.
Čím viac ľudí pochopí kartelovú medicínu, ktorá sa zaoberá rakovinou, tým lepšie. A čím viac ľudí pochopí, že existuje mnoho iných spôsobov, ako prežiť rakovinu bez otravy, pálenia alebo rezania, tým lepšie.
S poďakovaním Dr. Paulovi Marikovi.
Pozrime sa najprv na analógiu, ktorá sa zrodila na základe myšlienok v knihe.
Starostlivosť o pacientov s rakovinou – Aliancia FLCCC
Analógia: Mesto v obkľúčení
Predstavte si prosperujúce mesto (zdravé telo), ktoré chráni vyspelý obranný systém (imunitný systém) a poháňajú ho účinné elektrárne (mitochondrie). Rozvoj rakoviny je ako postupné rozvracanie infraštruktúry tohto mesta, kde:
Elektrárne mesta (mitochondrie) začnú zlyhávať, čo núti budovy (bunky) používať núdzové generátory (glykolýzu), ktoré sú menej účinné, ale umožňujú prežitie. Tieto narušené budovy začnú ignorovať stavebné predpisy mesta (normálna regulácia buniek) a začnú stavať nepovolené prístavby (nekontrolovaný rast). hlavné štvrte mesta (tkanivá) sa infiltrujú týmito nepovolenými budovami, ktoré:
vytvárajú vlastnú infraštruktúru (angiogenéza)
vytvárajú podzemné siete (cesty metastáz)
korumpujú miestnu políciu (imunitný systém)
nabúrajú sa do komunikačného systému mesta (bunkové signalizácie)
Obranný systém mesta čelí niekoľkým výzvam:
podvodné budovy sa maskujú ako legitímne štruktúry (imunitný únik)
niektoré budovy sa stávajú majstrami architektúry (rakovinové kmeňové bunky), ktorí dokážu prestavať celé nepovolené štvrte
vzbúrenci vytvárajú ochranné štvrte (nádorové mikroprostredie), v ktorých neplatia mestské zákony
Tradičná liečba rakoviny je ako rôzne vojenské stratégie:
chemoterapia: kobercové bombardovanie, ktoré poškodzuje budovy povstalcov aj lojálnych
ožarovanie: presné údery na konkrétne štvrte
imunoterapia: preškolenie a posilnenie mestskej polície
cielená terapia: odrezanie konkrétnych zásobovacích liniek alebo komunikačných sietí
metabolická terapia: prerušenie dodávok energie rebelom pri súčasnej ochrane infraštruktúry mesta
Prežitie mesta závisí od:
včasného odhalenia aktivít povstalcov
pochopenia jedinečných zraniteľných miest povstalcov
ochrany kritickej infraštruktúry
zachovania zásobovacích liniek pre lojálnych občanov
koordinácie viacerých stratégií reakcie
zabránenia rozšíreniu do ďalších miest (metastázy)
Táto analógia ilustruje, prečo je liečba rakoviny taká náročná – nejde o vonkajšieho útočníka, ale o komplexnú vnútornú vzburu, ktorá využíva vlastné systémy tela na prežitie a šírenie, čo si vyžaduje sofistikované, viacúčelové prístupy na účinnú liečbu.
20-bodové zhrnutie
Vývoj rakoviny zahŕňa komplexné interakcie medzi metabolickou dysfunkciou, genetickými mutáciami a faktormi prostredia, pričom čoraz viac dôkazov podporuje primárnu úlohu metabolických zmien ako iniciačných udalostí, a nielen následkov.
Warburgov efekt poukazuje na jedinečný metabolizmus rakovinových buniek, ktoré uprednostňujú glykolýzu aj v prítomnosti kyslíka, vďaka čomu je metabolické cielenie sľubným terapeutickým prístupom.
Heterogenita nádorov predstavuje veľkú výzvu pri liečbe, keďže rôzne bunkové populácie v rámci toho istého nádoru môžu vykazovať rôzne reakcie na liečbu, čo si vyžaduje viacúčelové prístupy.
Nádorové kmeňové bunky slúžia ako kľúčové faktory iniciácie, progresie a rezistencie na liečbu, čo z nich robí kľúčové terapeutické ciele na prevenciu recidívy.
Nádorové mikroprostredie významne ovplyvňuje výsledky liečby prostredníctvom komplexných interakcií medzi rakovinovými bunkami, imunitnými bunkami, krvnými cievami a okolitými tkanivami.
Imunoterapia sa stala revolučným liečebným prístupom, hoci jej úspech do veľkej miery závisí od individuálnych faktorov pacienta a špecifických vlastností nádoru.
Včasné odhalenie je naďalej rozhodujúce pre optimálne výsledky, pričom vo väčšine typov rakoviny existujú významné rozdiely v prežívaní medzi včasnou a neskorou diagnostikou.
Rezistencia na liečbu sa vyvíja prostredníctvom viacerých mechanizmov vrátane genetickej adaptácie, metabolických zmien a zmien mikroprostredia, čo si vyžaduje adaptívne stratégie liečby.
Prístupy personalizovanej medicíny založené na molekulárnom profilovaní a testovaní biomarkerov sú čoraz dôležitejšie pre optimalizáciu výberu liečby a jej výsledkov.
Ekonomické aspekty liečby rakoviny vrátane nákladov na vývoj liekov a dostupnosti zdravotnej starostlivosti významne ovplyvňujú dostupnosť liečby a výsledky pacientov.
Pri vývoji liečby zohrávajú kľúčovú úlohu koncepcia a regulácia klinických skúšok, hoci súčasné systémy môžu neúmyselne odrádzať od výskumu niektorých sľubných prístupov.
Faktory životného prostredia a životného štýlu vrátane stravy, stresu a fyzickej aktivity významne ovplyvňujú riziko vzniku rakoviny aj výsledky liečby.
Epigenetické modifikácie predstavujú kľúčové prepojenie medzi environmentálnymi vplyvmi a vývojom rakoviny a ponúkajú potenciálne terapeutické ciele.
Terapeutický prístup založený na lisovacích pulzoch predstavuje inovatívnu stratégiu zameranú na metabolickú zraniteľnosť rakoviny pri minimalizácii poškodenia zdravých buniek.
Rozhodnutia o liečbe čoraz viac ovplyvňujú úvahy o kvalite života, pričom sa vyvažujú výhody prežitia s vedľajšími účinkami a funkčnými dopadmi.
Medzinárodné výskumné normy a regulačné procesy ovplyvňujú globálny vývoj a dostupnosť liečby, čo vytvára príležitosti aj výzvy.
Úloha zápalu pri vývoji a progresii rakoviny viedla k novým terapeutickým stratégiám zameraným na zápalové dráhy.
Pokročilé zobrazovacie technológie a testovanie biomarkerov priniesli revolúciu v diagnostike, monitorovaní a výbere liečby.
Integrácia viacerých liečebných postupov vrátane konvenčných, cielených a metabolických prístupov ponúka najsľubnejšiu cestu vpred v prípade mnohých druhov rakoviny.
Pochopenie komplexného vzťahu medzi stresom, funkciou imunitného systému a progresiou rakoviny viedlo k zvýšenému dôrazu na prístupy komplexnej starostlivosti vrátane psychologickej podpory.
V texte sa objavujú viaceré pojmy s jediným významom: repurposed drugs, v slovenčine preklasifikované alebo nanovo preformulované (repurpované) lieky. Nechcel som používať stále jeden a ten istý termín v rozsiahlejšom texte, takže nejde o chybu, ale o zámer.PREDSLOV: Dr. Justus Hope
Ako lekár a certifikovaný špecialista som sa viac ako 30 rokov staral o pacientov, najmä tých, ktorí trpeli neznesiteľnou bolesťou. Keď v januári 2020 môj priateľ ochorel na glioblastóm, začal som skúmať spôsoby, ako mu pomôcť. To, čo som našiel, ma rozčúlilo: Môjmu priateľovi by sa mohlo dariť oveľa lepšie, keby jeho lekári pridali k chemoterapii, ožarovaniu a operácii kokteily liekov s novým určením (repurposed drugs).
Harvardský profesor prvýkrát narazil na novo preformulované lieky na rakovinu v 90. rokoch minulého storočia, keď ich použil na vyliečenie vlastného glioblastómu. Tento muž je dnes stále nažive.
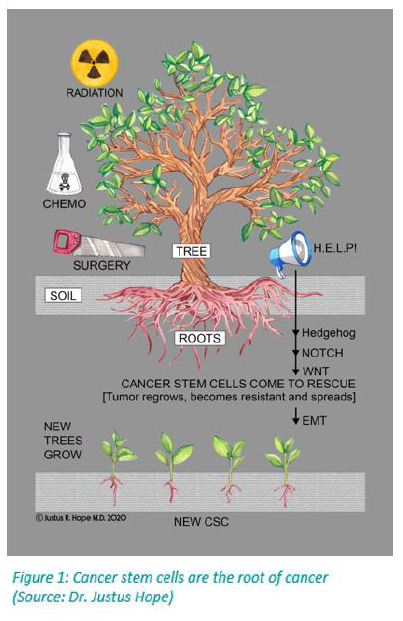
Najvýznamnejším problémom, ktorý opakovane vidím, je, že rakovina sa vracia s rezistentnými metastázami. Vtedy je to často prehratý boj aj s repurposed liekmi. K tejto tragédii dochádza preto, lebo štandardná liečba chirurgickým zákrokom, ožarovaním a chemoterapiou stimuluje rast rakovinových kmeňových buniek (pozri obrázok 1). Proaktívne pridávanie repurpovaných liekov čo najskôr môže pomôcť zabrániť prerastaniu rakovinových kmeňových buniek do odolnejšej a niekedy nezničiteľnej formy nádoru. Ak by sa nám podarilo presvedčiť všetkých pacientov a ich onkológov, aby si prečítali tento dokument a pridali koktail repurpovaných liekov spolu so zmenou životného štýlu hneď na začiatku diagnostikovania rakoviny (a urobili to v súlade s ich liečebným plánom – či už ide o chirurgický zákrok, chemoterapiu a rádioterapiu), pravdepodobne by sme videli, že oveľa viac týchto pacientov nielen prežije, ale bude žiť lepší a dlhší život.
Justus Hope je pseudonym. Autor vykonáva lekársku prax pod svojím menom. Napísal niekoľko kníh, medzi ktoré patrí Prežiť rakovinu, COVID-19 a Choroba: Revolúcia vo využívaní liekov s novým určením.
Predslov k 2. vydaniu knihy CANCER CARE
Dr. Justus Hope
Dr. Paul Marik, najviac publikujúci odborník o kritickej starostlivosti v Spojených štátoch, sa zaoberá rakovinou. Dr. Marik preskúmal tisíce štúdií a v tomto procese odhalil základné pravdy a vyvrátil pretrvávajúce mýty pri vydaní 1. vydania publikácie Cancer Care. Toto 2. vydanie ich rozširuje a pridáva propranolol, pomerne neznámu protirakovinovú látku. Okrem toho sa ivermektín na základe nových dôkazov posúva do prvej úrovne.
Je tu množstvo praktických návrhov a všetky sú založené na štúdiách PubMed, takže nikto nemôže spochybniť vedecký a dôkazový základ. Marik nám dáva návod, ktoré tri repurpované lieky treba užívať pred operáciou alebo biopsiou rakoviny, aby sa znížilo riziko rozšírenia rakoviny chirurgickou manipuláciou. Už dlho je známe, že rezanie nádoru predstavuje riziko šírenia rakoviny, avšak pacientov na to neupozornili. Marik uvádza, že štúdie ukázali, že tieto riziká možno znížiť predoperačným užívaním celekoxibu, propranololu alebo cimetidínu. Ešte lepšie je, ak kombinácia všetkých troch látok môže mať synergický účinok.
Moja recenzia 2. vydania knihy Dr. Marika Rakovina však poskytla oveľa viac a je mi cťou sa o ňu tu podeliť. Najprv mi dovoľte začať s hlavnou príčinou rakoviny.
Dr. Marik upozorňuje, že teória somatických mutácií, ktorú nás všetkých učili na lekárskej fakulte, nie je podložená rastúcimi údajmi. Rakovinu, ako nám desaťročia tvrdili, nespôsobuje séria mutácií, ktoré nakoniec vyústia do nekontrolovaného delenia buniek.
Namiesto toho údaje oveľa viac podporujú model mitochondriálnej dysfunkcie, ktorý presadzuje Dr. Thomas Seyfried. Keď sa mitochondrie rakovinových buniek transplantujú do normálnych buniek, normálne bunky sa stanú rakovinovými. Keď sa však jadrá rakovinových buniek transplantujú do normálnych buniek, rakovina sa neprenesie. Pôvodca sa prenáša v mitochondriách, nie v jadre. Ústredným problémom pri rakovine sú chybné mitochondrie, nie mutácie DNA.
Prečo pretrváva tento mýtus, že rakovina vzniká v dôsledku mutácií DNA?
Pretože teória somatických mutácií je príbehom a tento príbeh produkuje drahé a výnosné liečby. Výsledky sú stále nedostatočné. Naratív sa pravdepodobne v dohľadnej dobe nezmení, doktor Marik však poznamenáva, že riešenie liečby rakoviny podľa modelu mitochondriálnej dysfunkcie prináša odlišné terapie a oveľa lepšie výsledky.
Tieto liečebné postupy, ktoré sa môžu u väčšiny pacientov vykonávať ako doplnok štandardnej starostlivosti, môžu viesť k dlhšiemu prežívaniu – v niektorých prípadoch k úplnej remisii. A čo je možno ešte dôležitejšie, Marikove odporúčania môžu viesť k úplnému vyhnutiu sa rakovine, čo je perspektíva, ktorá by mohla zničiť zisky onkologického priemyslu.
Ale to odbočujem.
Prejdime k niektorým ďalším mýtom, ktoré Marik vyvracia.
„Slnečné žiarenie je pre vás zlé, pretože zvyšuje riziko rakoviny, a opaľovací krém je pre vás zdravý, pretože znižuje riziko rakoviny.“
Omyl. Je to presne naopak. V 2. vydaní Dr. Marik na základe viacerých štúdií presvedčivo ukazuje, ako slnečné svetlo znižuje riziko vzniku melanómu a zlepšuje prežívanie a ako opaľovací krém pôsobí opačne.
Keď sa u môjho priateľa a kolegu objavil glioblastóm, závažná rakovina mozgu s priemernou dobou prežitia 12,7 mesiaca, ponoril som sa do lekárskej literatúry a našiel som repurpované lieky. Po vydaní knihy v roku 2020 – Prežiť rakovinu, COVID-19 a Choroba: Revolúcia vo využívaní liekov s novým určením – o mojich zisteniach vrátane rozsiahlej dôkazovej základne o repurponovaných liekoch na rakovinu, môj priateľ pridal štyri z nich – Atorvastatín, Mebendazol, Metformín a Doxycyklín – do svojho liečebného plánu prostredníctvom onkologickej kliniky US Care a prežil približne 46 mesiacov - takmer 4-krát dlhšie, ako sa očakávalo.
Za to mu bola jeho rodina vďačná. Všetci sme však dúfali vo viac. A keď nakoniec zomrel, najväčšiu úlohu zohralo poškodenie ožiarením, nie rakovina. Dr. Thomas Seyfried si vo svojich rozhovoroch o glioblastóme všimol rovnaký problém. Seyfried vysvetľuje, že mozog by sa nikdy nemal ožarovať. Škoda len, že sme tieto informácie nemali v roku 2020. Vtedy sme potrebovali vedomosti Dr. Seyfrieda a Dr. Marika o rakovine. Môj priateľ mohol dopadnúť lepšie a žiť dlhšie.
Čo ma privádza k propranololu. Dr. Marik ho radí na druhé miesto v podpore dôkazov hneď za vitamín D3. Prečo? V knihe sa venuje všetkým technickým a podrobným protirakovinovým cestám propranololu. Jej podstata je však takáto:
Propranolol je beta blokátor, ktorý chráni účinok katecholamínov na organizmus. Katecholamíny ako noradrenalín a adrenalín sa uvoľňujú, keď sa stretávame so stresom, a stres zvyšuje pravdepodobnosť vzniku rakoviny. Preto propranolol blokovaním katecholamínov znižuje riziko vzniku rakoviny.
Kľúčovou vlastnosťou tohto betablokátora však je, že znižuje metastatické šírenie.
To ma privádza k jednej z obľúbených častí pripravovanej knihy doktora Marika. Tri repurpované lieky môžu ponúknuť preventívne účinky proti metastatickému šíreniu u tých, ktorí podstupujú operáciu rakoviny. Patrí medzi ne celekoxib, cimetidín a propranolol. Doktor Marik píše, že ich kombinácia môže byť synergická.
Dr. Paul Marik posunul vedu o repurpovaných liekoch pri rakovine na svetovú úroveň. Cancer Care 1. vydanie je hodné doktorandskej práce s viac ako 1,200 citáciami v databáze PubMed. Marik si v tomto novom vydaní vyslúžil ďalší titul PhD s viac ako 1,300 citáciami. Najčastejšie publikujúci odborník na kritickú starostlivosť v Spojených štátoch sa stal najdôveryhodnejším vedeckým hlasom pre repurpované lieky v prevencii a liečbe rakoviny.
A čo sa týka osobnej poznámky, rozhovor s doktorom Marikom bol príjemným dobrodružstvom. Rozprávať sa s ním je ako rozprávať sa so svojím najlepším priateľom, hoci s juhoafrickým prízvukom a znalosťou témy ako z umelej inteligencie. Má najpozoruhodnejšiu kombináciu intelektu, súcitu a pokory spomedzi všetkých, ktorých poznám.
Prvé a druhé vydanie knihy Dr. Marika Cancer Care zmení prístup sveta k rakovine.
Justus R. Hope, MD
Redding, Kalifornia
Máj 2024
Liečba rakoviny
Úloha nanovo preformulovaných (repurposed) liekov a metabolických intervencií v liečbe rakoviny
Paul E. Marik, MD, FCCM, FCCP
– Cancer Care Flccc Dr. Paul Marik V2
– Súhrn starostlivosti o rakovinu 2023 9 8
50 otázok a odpovedí
Otázka 1: Ako sa líši model mitochondriálnej dysfunkcie od teórie somatických mutácií pri vysvetľovaní vzniku rakoviny?
Odpoveď: Model mitochondriálnej dysfunkcie predpokladá, že rakovina vzniká v dôsledku poškodeného bunkového dýchania v mitochondriách, čo vedie ku kompenzačnej fermentácii a metabolickým zmenám, ktoré vedú k rozvoju rakoviny. Tento model, podporovaný výskumníkmi ako Thomas Seyfried, naznačuje, že genetické mutácie sú skôr následným účinkom než primárnou príčinou rakoviny.
Naopak, teória somatických mutácií považuje rakovinu za primárne spôsobenú mutáciami DNA, ktoré sa časom hromadia, čo vedie k nekontrolovanému rastu buniek. Hoci oba modely uznávajú prítomnosť genetických zmien, zásadne sa líšia v chápaní príčinnej súvislosti – mitochondriálny model považuje za iniciátora metabolickú dysfunkciu, zatiaľ čo mutačná teória považuje za spúšťač genetické zmeny.
Otázka 2: Čo je to Warburgov efekt a ako súvisí s metabolizmom rakovinových buniek?
Odpoveď: Warburgov efekt opisuje jedinečný metabolický model pozorovaný v rakovinových bunkách, ktoré prednostne využívajú glykolýzu na produkciu energie aj v prítomnosti kyslíka, čo ako prvý zdokumentoval Otto Warburg. Tento proces, známy aj ako aeróbna glykolýza, je menej účinný ako normálna oxidačná fosforylácia, ale poskytuje rakovinovým bunkám výhody pre rýchly rast a prežitie.
Tento metabolický posun umožňuje rakovinovým bunkám vyrábať energiu a stavebné prvky pre nové bunky a zároveň udržiavať priaznivé mikroprostredie pre rast nádoru. Zvýšená spotreba glukózy a produkcia laktátu spojená s Warburgovým efektom tiež vytvára kyslé prostredie, ktoré môže podporovať inváziu nádoru a potláčať reakciu imunitného systému.
Otázka č. 3: Ako fungujú press-pulse protokoly pri liečbe rakoviny a čím sa odlišujú od bežných prístupov?
Odpoveď: Press-pulse protokoly kombinujú trvalý metabolický tlak („press“) s akútnymi stresormi („pulse“), aby sa zamerali na jedinečné metabolické zraniteľnosti rakovinových buniek. Fáza tlaku zvyčajne zahŕňa úpravy stravy alebo metabolické terapie, ktoré vytvárajú trvalý stres na rakovinové bunky, zatiaľ čo fáza pulzu zavádza periodické akútne stresory, ako sú cielené liečby vysokými dávkami alebo hyperbarická kyslíková terapia.
Tento prístup sa od bežnej liečby líši tým, že systematicky využíva metabolické slabiny rakovinových buniek a zároveň minimalizuje poškodenie zdravých buniek. Na rozdiel od tradičnej chemoterapie alebo ožarovania, ktoré sú primárne zamerané na rýchlo sa deliace bunky, sa press-pulse protokoly zameriavajú na narušenie základných metabolických procesov, od ktorých závisí prežitie rakovinových buniek.
Otázka 4: Akú úlohu zohrávajú kmeňové rakovinové bunky pri vývoji nádorov a odolnosti voči liečbe?
Odpoveď: Rakovinové kmeňové bunky (cancer stem cells – CSC) fungujú ako bunky iniciujúce vznik nádoru, ktoré sú schopné sebaobnovy a diferenciácie a slúžia ako primárna hnacia sila rastu a progresie nádoru. Tieto bunky majú jedinečné metabolické vlastnosti, ktoré im umožňujú prežiť tradičnú liečbu a regenerovať nádory, čo z nich robí kľúčové ciele pre účinnú liečbu rakoviny.
Rezistencia na liečbu sa často vyvíja, pretože CSC môžu prejsť do pokojového stavu, čím sa stávajú menej zraniteľnými voči bežným terapiám, ktoré sú zamerané na rýchlo sa deliace bunky. Okrem toho tieto bunky exprimujú špecifické povrchové markery a udržiavajú si aktívne mechanizmy opravy DNA, čo im umožňuje prežiť a potenciálne iniciovať recidívu nádoru aj po zdanlivo úspešnej liečbe.
Otázka 5: Ako výskum Otta Warburga ovplyvnil moderné chápanie metabolizmu rakoviny?
Odpoveď: Priekopnícky výskum Otta Warburga v 20. rokoch 20. storočia zásadne zmenil naše chápanie rakoviny tým, že identifikoval charakteristický metabolický vzorec rakovinových buniek, ktoré uprednostňujú fermentáciu glukózy aj v prítomnosti kyslíka. Jeho práca položila základy metabolických prístupov k liečbe rakoviny a naďalej ovplyvňuje moderný výskum energetického metabolizmu rakovinových buniek.
Vplyv Warburgových objavov presahuje jeho pôvodné zistenia a inšpiruje súčasných výskumníkov k skúmaniu metabolického zamerania ako terapeutickej stratégie. Jeho pozorovania viedli k vývoju rôznych diagnostických nástrojov vrátane PET skenov, ktoré využívajú vysokú absorpciu glukózy rakovinovými bunkami, a ovplyvnili vývoj metabolických terapií zameraných na jedinečné energetické požiadavky rakoviny.
Otázka 6: Aké dôkazy podporujú liečbu rakoviny ako metabolického ochorenia, a nie ako genetického ochorenia?
Odpoveď: Viaceré štúdie preukázali, že transplantácia zdravých jadier do cytoplazmy rakovinových buniek nedokáže zvrátiť rakovinový stav, zatiaľ čo prenos jadier rakovinových buniek do zdravej cytoplazmy vedie k normálnemu vývoju buniek. Tieto experimentálne dôkazy silne naznačujú, že cytoplazmatické prostredie, najmä funkcia mitochondrií, zohráva pri vývoji rakoviny rozhodujúcejšiu úlohu ako mutácie jadrovej DNA.
Klinické pozorovania tiež ukazujú, že mnohé mutácie súvisiace s rakovinou sa objavujú v zdravých tkanivách bez toho, aby spôsobili rakovinu, zatiaľ čo niektoré druhy rakoviny sa vyvíjajú bez typických onkogénnych mutácií. Okrem toho úspešnosť metabolických zásahov pri liečbe rôznych druhov rakoviny v kombinácii s univerzálnymi metabolickými charakteristikami spoločnými pre rôzne typy rakoviny podporuje metabolickú paradigmu.
Otázka 7: Ako sa líši oxidačná fosforylácia a glykolýza v normálnych bunkách v porovnaní s rakovinovými bunkami?
Odpoveď: Normálne bunky sa pri produkcii energie spoliehajú predovšetkým na oxidačnú fosforyláciu, ktorá vytvára 36 molekúl ATP na jednu molekulu glukózy prostredníctvom účinného procesu v mitochondriách závislého od kyslíka. Tento proces zahŕňa kompletné odbúravanie glukózy prostredníctvom cyklu kyseliny citrónovej a elektrónového transportného reťazca, čo poskytuje optimálny energetický výťažok pre bunkové funkcie.
Naopak, rakovinové bunky využívajú prevažne glykolýzu aj v prítomnosti kyslíka, pričom produkujú len 2 molekuly ATP na molekulu glukózy, ale vytvárajú metabolické medziprodukty potrebné na rýchle delenie buniek. Tento neefektívny proces si vyžaduje, aby rakovinové bunky spotrebovali podstatne viac glukózy ako normálne bunky, čo vedie k charakteristickému vysokému príjmu glukózy pozorovanému v nádoroch.
Otázka 8: Aké sú hlavné rozdiely medzi tradičnou liečbou rakoviny a prístupmi metabolickej terapie?
Odpoveď: Tradičné spôsoby liečby rakoviny sú zamerané predovšetkým na rýchlo sa deliace bunky prostredníctvom cytotoxických mechanizmov, čo často vedie k značnému vedľajšiemu poškodeniu zdravých tkanív. Tieto prístupy vrátane chemoterapie a ožarovania sa zameriavajú na priame zabíjanie rakovinových buniek bez toho, aby sa nevyhnutne zaoberali základnými metabolickými podmienkami, ktoré podporujú ich rast.
Metabolické terapeutické prístupy sa naopak zameriavajú na využitie jedinečných metabolických zraniteľností rakovinových buniek a zároveň podporujú funkciu zdravých buniek. Tieto liečebné postupy často kombinujú úpravy stravy, cielené doplnky a špecifické protokoly liečby navrhnuté tak, aby narušili metabolizmus rakovinových buniek a zároveň zvýšili normálnu produkciu bunkovej energie, čo môže priniesť menej vedľajších účinkov a lepšie dlhodobé výsledky.
Otázka 9: Ako prispieva dysfunkcia bunkového dýchania k vzniku rakoviny?
Odpoveď: Dysfunkcia bunkového dýchania sa zvyčajne začína poškodením schopnosti mitochondrií efektívne produkovať energiu prostredníctvom oxidačnej fosforylácie. Toto poškodenie núti bunky, aby sa pri výrobe energie viac spoliehali na fermentáciu, čo vedie k zmenám v bunkovom metabolizme, ktoré môžu podporovať rozvoj a progresiu rakoviny.
Odklon od účinnej oxidačnej fosforylácie vytvára kaskádu účinkov vrátane zmenenej expresie génov, zvýšenej produkcie reaktívnych foriem kyslíka a zmien v bunkových signálnych dráhach. Tieto zmeny môžu vytvoriť prostredie, ktoré podporuje prežívanie a šírenie rakovinových buniek a zároveň ohrozuje normálne bunkové regulačné mechanizmy.
Otázka 10: Aký vplyv mal program The Cancer Genome Atlas na výskum a liečbu rakoviny?
Odpoveď: Program Cancer Genome Atlas vytvoril komplexné genomické profily tisícov vzoriek rakoviny rôznych typov, čím poskytol bezprecedentný pohľad na genetické zmeny spojené s rôznymi druhmi rakoviny. Táto obrovská databáza umožnila výskumníkom identifikovať spoločné vzorce mutácií a potenciálne terapeutické ciele, čo viedlo k vývoju cielenejších liečebných prístupov.
Program však odhalil aj neočakávanú zložitosť genetiky rakoviny, keď ukázal, že mnohé druhy rakoviny nemajú jasné riadiace mutácie a že genetické profily sa môžu výrazne líšiť aj v rámci toho istého typu nádoru. Táto komplexnosť spochybnila tradičný pohľad na rakovinu zameraný na mutácie a zdôraznila potrebu komplexnejších prístupov k liečbe rakoviny.
Otázka 11: Ako ovplyvňujú predpisy o klinických skúškach vývoj nových spôsobov liečby rakoviny?
Odpoveď: Predpisy o klinickom skúšaní vytvárajú štruktúrovaný rámec, ktorý vyžaduje rozsiahle testovanie bezpečnosti a účinnosti predtým, ako sa nové liečby dostanú k pacientom. Tento proces zvyčajne zahŕňa viacero fáz, ktoré sa začínajú štúdiami bezpečnosti na malých skupinách a pokračujú väčšími skúškami účinnosti, ktoré často trvajú 7 až 10 rokov a stoja stovky miliónov dolárov.
Tieto predpisy síce zabezpečujú bezpečnosť pacientov, ale zároveň môžu spomaliť zavádzanie sľubných liečebných postupov a obmedziť testovanie kombinovaných terapií. Prísne požiadavky ovplyvňujú najmä vývoj metabolických terapií a liekov s novým určením, ktoré často nemajú finančnú podporu potrebnú na zvládnutie nákladného schvaľovacieho procesu.
Otázka 12: Akú úlohu zohráva FDA pri schvaľovaní a regulácii liečby rakoviny?
Odpoveď: FDA slúži ako hlavný kontrolór pri schvaľovaní liečby rakoviny v Spojených štátoch a stanovuje normy bezpečnosti a účinnosti prostredníctvom viacfázového procesu preskúmania. Táto agentúra hodnotí všetky údaje z klinických skúšok, výrobné postupy a bezpečnostné protokoly pred schválením novej liečby rakoviny a zároveň monitoruje bezpečnosť a účinnosť po uvedení na trh. Po prvotnom schválení FDA naďalej dohliada na úpravy liečby, zmeny vo výrobe a monitorovanie bezpečnosti prostredníctvom rôznych požiadaviek na podávanie správ a inšpekčných programov. Rozhodnutia agentúry významne ovplyvňujú dostupnosť liečby, smerovanie výskumu a investície farmaceutických spoločností do vývoja liekov proti rakovine.
Otázka 13: Ako ovplyvňujú náklady na liečbu dostupnosť a výsledky onkologickej starostlivosti?
Odpoveď: Náklady na liečbu vytvárajú významné prekážky v prístupe k onkologickej starostlivosti, pričom mnohí pacienti čelia finančnej toxicite, ktorá môže viesť k bankrotu, oneskoreniu alebo prerušeniu liečby. Vysoké náklady na novšie cielené terapie a imunoterapiu, ktoré môžu presiahnuť 100,000 USD ročne, často nútia pacientov k ťažkej voľbe medzi finančnou stabilitou a optimálnymi možnosťami liečby.
Obmedzenia poistného krytia, vysoké spoluúčasti a doplatky ešte viac zhoršujú problém dostupnosti a vytvárajú rozdiely vo výsledkoch liečby na základe socioekonomického postavenia. Tieto finančné prekážky často vedú k tomu, že pacienti si vyberajú lacnejšiu, ale potenciálne menej účinnú liečbu alebo sa vzdávajú odporúčanej následnej starostlivosti a monitorovania.
Otázka 14: Aký význam má heterogenita nádorov pri liečbe rakoviny?
Odpoveď: Heterogenita nádoru znamená prítomnosť rôznych bunkových populácií v rámci jedného nádoru, z ktorých každá môže mať odlišné genetické profily, metabolické charakteristiky a citlivosť na liečbu. Táto rozmanitosť v rámci nádorov vysvetľuje, prečo liečba s jedným cieľom často nedosahuje úplné odpovede a prečo sa u rakoviny často vyvíja rezistencia na pôvodne účinnú liečbu.
Komplexná povaha heterogenity nádorov si vyžaduje viacúčelové liečebné prístupy, ktoré môžu súčasne pôsobiť na rôzne bunkové populácie. Pochopenie tejto heterogenity viedlo k vývoju kombinovaných terapií a personalizovaných liečebných stratégií, ktoré sú zamerané na viaceré aspekty biológie nádorov.
Otázka 15: Ako fungujú mechanizmy metastázovania a prečo sú dôležité pri progresii rakoviny?
Odpoveď: Metastázovanie zahŕňa komplexný rad krokov, pri ktorých sa rakovinové bunky oddeľujú od primárneho nádoru, dostávajú sa do krvného obehu alebo lymfatického systému a zakladajú nové nádory na vzdialených miestach. Tento proces si vyžaduje, aby bunky podstúpili významné zmeny svojich adhéznych vlastností, prežili v obehu a prispôsobili sa novému tkanivovému prostrediu.
Schopnosť metastázovať predstavuje najnebezpečnejší aspekt rakoviny, ktorý je príčinou približne 90% úmrtí súvisiacich s rakovinou. Pochopenie mechanizmov metastázovania je kľúčové, pretože rakovinové bunky, ktoré úspešne metastázujú, si často vyvinú rezistenciu na liečbu, ktorá bola účinná proti primárnemu nádoru, čo si vyžaduje odlišné terapeutické prístupy.
Otázka 16: Aké hierarchie dôkazov sa používajú na hodnotenie výskumu rakoviny?
Odpoveď: Hierarchie dôkazov vo výskume rakoviny umiestňujú na vrchol randomizované kontrolované štúdie (RCT) a systematické prehľady, po ktorých nasledujú kohortové štúdie, štúdie prípadov a kontrol a správy o prípadoch v zostupnom poradí podľa spoľahlivosti. Táto štruktúra pomáha lekárom a výskumníkom hodnotiť silu dôkazov podporujúcich rôzne liečebné prístupy a výsledky výskumu.
Hierarchia zohľadňuje aj faktory, ako je kvalita dizajnu štúdie, veľkosť vzorky a replikácia výsledkov vo viacerých štúdiách. Metaanalýzy kombinujúce údaje z viacerých vysokokvalitných štúdií poskytujú obzvlášť silné dôkazy, hoci reálne dôkazy a pozorovacie štúdie získavajú uznanie pre svoju schopnosť odhaliť účinky liečby v rôznych populáciách pacientov.
Otázka 17: Ako sa preklasifikované lieky začleňujú do stratégií liečby rakoviny?
Odpoveď: Novo preformulované lieky pôvodne schválené na iné ochorenia, ponúkajú potenciálne účinnú liečbu rakoviny pri nižších nákladoch a s dobre pochopeným bezpečnostným profilom. Tieto lieky sa často zameriavajú na metabolické dráhy alebo bunkové mechanizmy, ktoré sú relevantné tak pre ich pôvodnú indikáciu, ako aj pre liečbu rakoviny, čím sa stávajú cenným doplnkom liečebných protokolov.
Medzi hlavné výhody repurposingu liekov patria znížené náklady na vývoj, kratší čas do klinickej implementácie a rozsiahle údaje o bezpečnosti získané počas rokov klinického používania. Tieto lieky však často čelia problémom pri získavaní oficiálneho schválenia na liečbu rakoviny z dôvodu obmedzených finančných stimulov pre farmaceutické spoločnosti na financovanie potrebných klinických skúšok.
Otázka 18: Aké faktory ovplyvňujú úspešnosť imunoterapeutickej liečby?
Odpoveď: Úspech imunoterapie do veľkej miery závisí od stavu imunitného systému pacienta, typu nádoru a špecifických molekulárnych markerov prítomných na rakovinových bunkách. Faktory ako mutačná záťaž nádoru, úroveň expresie PD-L1 a stav mikrosatelitnej nestability významne ovplyvňujú mieru odpovede na liečbu.
Faktory prostredia vrátane zloženia mikrobiómu pacienta, celkového zdravotného stavu a predchádzajúcej liečby tiež zohrávajú kľúčovú úlohu pri určovaní výsledkov imunoterapie. Načasovanie podávania imunoterapie a jej kombinácia s inými liečebnými modalitami môže významne ovplyvniť jej účinnosť.
Otázka 19: Ako prispieva genomická nestabilita k vzniku rakoviny?
Odpoveď: Genomická nestabilita vytvára prostredie, v ktorom sa poškodenia DNA hromadia rýchlejšie ako v normálnych bunkách, čo vedie k zvýšenému počtu mutácií a chromozomálnych abnormalít. Tento proces urýchľuje získavanie mutácií podporujúcich rakovinu a pomáha vysvetliť progresívny charakter vývoja rakoviny.
Zdá sa, že vzťah medzi genomickou nestabilitou a metabolickou dysfunkciou je obojsmerný, pričom metabolický stres prispieva k poškodeniu DNA a nedostatkom pri jej oprave, zatiaľ čo genetické zmeny môžu ďalej narušiť normálny bunkový metabolizmus. Táto komplexná interakcia vytvára samoposilňujúci sa cyklus, ktorý podporuje progresiu rakoviny a rezistenciu na liečbu.
Otázka 20: Akú úlohu zohrávajú environmentálne faktory pri riziku vzniku rakoviny a jej prevencii?
Odpoveď: Environmentálne faktory významne ovplyvňujú riziko rakoviny prostredníctvom rôznych mechanizmov vrátane priameho poškodenia DNA, epigenetických modifikácií a zmien v bunkovom metabolizme. Tieto faktory zahŕňajú širokú škálu expozícií, od výberu stravy a úrovne fyzickej aktivity až po vystavenie chemickým látkam a žiareniu.
Vplyv environmentálnych faktorov sa líši v závislosti od individuálnej genetickej náchylnosti, načasovania expozície a trvania expozície. Pochopenie týchto vzťahov viedlo k vypracovaniu stratégií prevencie, ktoré sa zameriavajú na modifikovateľné rizikové faktory, hoci komplexné interakcie medzi environmentálnymi expozíciami a biologickými reakciami často sťažujú stanovenie priamych kauzálnych vzťahov.
Otázka 21: Ako hormonálne faktory ovplyvňujú vývoj a progresiu rakoviny?
Odpoveď: Hormóny pôsobia ako silné regulátory bunkového rastu, diferenciácie a metabolizmu a priamo ovplyvňujú riziko vzniku a progresie rakoviny prostredníctvom viacerých ciest. Estrogén, testosterón, inzulín a rastové hormóny môžu podporovať proliferáciu buniek, meniť expresiu génov a ovplyvňovať energetický metabolizmus buniek spôsobom, ktorý podporuje vznik a rast rakoviny.
Načasovanie hormonálnej expozície počas života zohráva kľúčovú úlohu, pričom obdobia ako puberta, tehotenstvo a menopauza predstavujú obzvlášť citlivé obdobia. Toto poznanie viedlo k vývoju terapií zameraných na hormóny a preventívnych stratégií vrátane používania selektívnych modulátorov hormonálnych receptorov pri rakovine prsníka a prostaty.
Otázka 22: Aké sú hlavné rozdiely medzi pozorovacími štúdiami a klinickými skúškami vo výskume rakoviny?
Odpoveď: Pozorovacie štúdie skúmajú vzorce a výsledky rakoviny v reálnych podmienkach bez zásahu, čo umožňuje výskumníkom identifikovať súvislosti medzi rôznymi faktormi a vývojom alebo progresiou rakoviny. Tieto štúdie často poskytujú cenné poznatky o dlhodobých výsledkoch, zriedkavých vedľajších účinkoch a účinnosti liečby v rôznych populáciách, ktoré nie sú zvyčajne zahrnuté do klinických štúdií.
Naopak, klinické štúdie zahŕňajú kontrolované zásahy, pri ktorých výskumníci aktívne manipulujú s premennými s cieľom otestovať špecifické hypotézy o účinnosti a bezpečnosti liečby. Hoci klinické skúšky poskytujú najpresvedčivejšie dôkazy o príčinných súvislostiach a účinnosti liečby, často majú prísnejšie kritériá zaradenia a nemusia plne reprezentovať reálne populácie pacientov.
Otázka 23: Ako patentový systém ovplyvňuje vývoj a dostupnosť liekov proti rakovine?
Odpoveď: Patentový systém poskytuje farmaceutickým spoločnostiam dočasný monopol na nové lieky, čím motivuje k investíciám do nákladných výskumných a vývojových programov. Táto ochrana umožňuje spoločnostiam účtovať počas patentového obdobia vyššie ceny, aby sa im vrátili náklady na vývoj a dosiahli zisk, čo významne ovplyvňuje ceny a dostupnosť liekov.
Tento systém však zároveň odrádza od vývoja liečebných postupov s obmedzenou patentovou ochranou, ako sú napríklad opätovne používané lieky alebo prírodné zlúčeniny. Zameranie na patentovateľné inovácie často odvádza výskum od potenciálne účinných, ale menej ziskových liečebných postupov, čo ovplyvňuje typy vyvinutých liečebných postupov a ich prípadné náklady pre pacientov.
Otázka 24: Akú úlohu zohrávajú metaanalýzy pri určovaní účinnosti liečby rakoviny?
Odpoveď: Metaanalýzy spájajú a štatisticky analyzujú výsledky viacerých štúdií, čím poskytujú komplexný pohľad na účinnosť liečby v rôznych populáciách pacientov a výskumných prostrediach. Tento prístup zvyšuje štatistickú silu a môže odhaliť vzory alebo účinky, ktoré nemusia byť zrejmé v jednotlivých štúdiách, najmä v prípade liečby s miernym prínosom alebo špecifickými účinkami na podskupiny.
Systematická povaha metaanalýz pomáha identifikovať potenciálne zaujatosti, nekonzistentnosti a medzery v súčasnom výskume a zároveň poskytuje presnejšie odhady účinkov liečby. Tieto štúdie často slúžia ako podklad pre klinické usmernenia a odporúčania týkajúce sa liečby, hoci ich platnosť do veľkej miery závisí od kvality zahrnutých štúdií a vhodnosti použitých štatistických metód.
Otázka 25: Ako ovplyvňujú opatrenia týkajúce sa kvality života rozhodnutia o liečbe rakoviny?
Odpoveď: Merania kvality života poskytujú dôležité informácie o vplyve liečby nad rámec štatistík o prežívaní vrátane fyzických symptómov, emocionálnej pohody a funkčnej kapacity. Tieto opatrenia pomáhajú pacientom a lekárom prijímať informované rozhodnutia tým, že vyvažujú potenciálne prínosy prežitia oproti vedľajším účinkom liečby a ich vplyvu na každodenný život.
Začlenenie hodnotenia kvality života do plánovania liečby viedlo k prístupu, ktorý je viac zameraný na pacienta, vrátane vývoja menej toxickej liečby a lepších stratégií podpornej starostlivosti. Tieto opatrenia tiež pomáhajú identifikovať oblasti, v ktorých by dodatočná podpora alebo intervencia mohla zlepšiť výsledky liečby a spokojnosť pacientov.
Otázka 26: Aký je vzťah medzi vekom matky pri prvom pôrode a rizikom vzniku rakoviny?
Odpoveď: Vek matky pri prvom pôrode ovplyvňuje riziko rakoviny prostredníctvom komplexných hormonálnych a bunkových mechanizmov, ktoré ovplyvňujú vývoj tkanív a dlhodobú náchylnosť na rakovinu. U žien, ktoré majú prvé dieťa v mladšom veku, sa vo všeobecnosti znižuje riziko rakoviny prsníka v dôsledku včasnej diferenciácie prsného tkaniva a zmien hormonálnych profilov, ktoré vytvárajú menej rakovinotvorné prostredie.
Ochranný účinok zrejme súvisí s načasovaním diferenciácie buniek v tkanivách citlivých na hormóny a modifikáciou populácií kmeňových buniek. Tento vzťah sa však líši podľa typu rakoviny a je ovplyvnený ďalšími reprodukčnými faktormi, ako je celkový počet tehotenstiev, dĺžka dojčenia a celková hormonálna expozícia počas života.
Otázka 27: Ako potenciálne ovplyvňujú pôrody cisárskym rezom riziko rakoviny u potomkov?
Odpoveď: Pôrody cisárskym rezom ovplyvňujú riziko rakoviny potomkov prostredníctvom zmien v ranom vývoji mikrobiómu a programovaní imunitného systému. Deti narodené cisárskym rezom nie sú počas pôrodu vystavené prospešným materským vaginálnym a črevným baktériám, čo môže viesť k rozdielom vo vývoji imunitného systému a metabolického programovania.
Tieto rozdiely v ranom veku môžu ovplyvniť dlhodobú náchylnosť na rakovinu prostredníctvom zmenených zápalových reakcií a metabolickej regulácie. Výskum naznačuje, že pôrod cisárskym rezom je spojený s miernym zvýšením výskytu niektorých druhov rakoviny u detí, hoci mechanizmy sa stále skúmajú a môžu zahŕňať viacero faktorov vrátane operačného stresu a vystavenia antibiotikám.
Otázka 28: Akú úlohu zohráva veľkosť rodiny v epidemiológii rakoviny?
Odpoveď: Veľkosť rodiny ovplyvňuje riziko vzniku rakoviny prostredníctvom rôznych biologických a environmentálnych ciest vrátane zmien vo vývoji imunitného systému a spôsobov expozície. Väčšie rodiny často vykazujú odlišné vzorce vystavenia infekciám v detstve, ktoré môžu ovplyvniť vývoj imunitného systému a následné riziko rakoviny v neskoršom veku.
Vzťah medzi veľkosťou rodiny a rizikom rakoviny zahŕňa aj sociálno-ekonomické faktory, vzorce životného štýlu a reprodukčné správanie. Tieto súvislosti sa líšia podľa typu rakoviny a často ich modifikujú faktory, ako je poradie narodenia, odstupy medzi súrodencami a spoločné vystavenie environmentálnym vplyvom v rámci rodinnej jednotky.
Otázka 29: Ako ovplyvňujú medzinárodné výskumné normy celosvetový vývoj liečby rakoviny?
Odpoveď: Medzinárodné výskumné štandardy zabezpečujú konzistentnosť a kvalitu výskumu rakoviny v rôznych krajinách a inštitúciách, čo uľahčuje porovnávanie a kombinovanie výsledkov z viacerých štúdií. Tieto normy stanovujú spoločné protokoly na vykonávanie klinických štúdií, podávanie správ o výsledkoch a ochranu práv pacientov, čo umožňuje spoločné výskumné úsilie a rýchlejší vývoj nových liečebných postupov.
Rozdiely v regulačných požiadavkách a výskumnej infraštruktúre medzi jednotlivými krajinami však môžu spôsobovať problémy pri realizácii globálnych štúdií a prenose výsledkov do praxe. Tieto rozdiely môžu ovplyvniť všetko od návrhu štúdie až po nábor pacientov, čo môže obmedziť zovšeobecnenie výsledkov a spôsobiť rozdiely v prístupe k novej liečbe.
Otázka 30: Aký význam má apoptóza pri liečbe rakoviny?
Odpoveď: V čom spočíva význam apoptózy? Apoptóza alebo programovaná bunková smrť predstavuje kľúčový cieľ v liečbe rakoviny, pretože rakovinové bunky často vyvíjajú mechanizmy, ako sa tomuto prirodzenému procesu vyhnúť. Účinná liečba rakoviny musí často prekonať tieto mechanizmy prežitia a vyvolať bunkovú smrť rakovinových buniek, pričom sa ušetrí zdravé tkanivo.
Pochopenie molekulárnych dráh zapojených do apoptózy viedlo k vývoju cielených terapií, ktoré špecificky aktivujú signály smrti v rakovinových bunkách. Úspech týchto liečebných postupov často závisí od ich schopnosti prekonať viaceré anti-apoptotické mechanizmy, ktoré si rakovinové bunky vyvíjajú, čo si vyžaduje kombinované prístupy zamerané na rôzne aspekty regulácie bunkovej smrti.
Otázka 31: Ako prispievajú bunkové signálne dráhy k rozvoju rakoviny?
Odpoveď: Bunkové signálne dráhy tvoria komplexné siete, ktoré regulujú rast, prežívanie a metabolizmus buniek, pričom poruchy týchto dráh často vedú k vzniku rakoviny. Aberantná signalizácia môže byť dôsledkom mutácií, environmentálnych faktorov alebo metabolických zmien, čím sa vytvárajú samopodporujúce slučky, ktoré podporujú nepretržitý rast a prežívanie buniek aj v nepriaznivých podmienkach.
Tieto dráhy sa v rakovinových bunkách často prepájajú, čím sa vytvárajú nadbytočné mechanizmy prežitia, ktoré sťažujú liečbu. Pochopenie týchto signálnych sietí viedlo k vývoju cielených terapií, ktoré sa snažia blokovať špecifické dráhy, hoci rakovinové bunky si často vytvárajú alternatívne signálne dráhy, aby si udržali svoje výhody rastu a prežitia.
Otázka 32: Akú úlohu zohráva Európska agentúra pre lieky pri schvaľovaní liečby rakoviny?
Odpoveď: Európska agentúra pre lieky (EMA) hodnotí a monitoruje liečbu rakoviny v celej Európskej únii a zabezpečuje centralizovaný schvaľovací proces, ktorý ovplyvňuje vývoj a dostupnosť liekov na celom svete. Rozhodnutia agentúry ovplyvňujú prístup k liečbe pre milióny pacientov a pomáhajú stanoviť medzinárodné normy bezpečnosti a účinnosti liekov.
Prístup agentúry EMA sa často líši od iných regulačných orgánov v hodnotiacich kritériách a schvaľovacích procesoch, čo niekedy vedie k rozdielnej dostupnosti liečby v jednotlivých regiónoch. Tieto rozdiely môžu poskytnúť cenné porovnávacie údaje o výsledkoch liečby a bezpečnostných profiloch v rôznych populáciách a systémoch zdravotnej starostlivosti.
Otázka č. 33: Ako ovplyvňuje politika poistenia možnosti liečby rakoviny?
Odpoveď: Politiky poistného krytia priamo ovplyvňujú rozhodnutia o liečbe prostredníctvom obmedzení formulárov, požiadaviek na predchádzajúce povolenie a štruktúry spoluúčasti na nákladoch. Tieto politiky môžu obmedziť prístup k určitým liečebným postupom alebo nútiť pacientov, aby sa rozhodovali medzi liečebnými možnosťami skôr na základe finančných než medicínskych hľadísk.
Zložitosť poistného krytia často vytvára rozdiely v prístupe k liečbe, pričom niektorí pacienti dostávajú optimálnu starostlivosť, zatiaľ čo iní čelia výrazným prekážkam pri odporúčanej liečbe. Táto situácia ovplyvňuje najmä prístup k novším terapiám, klinickým skúškam a službám podpornej starostlivosti, ktoré by mohli zlepšiť výsledky liečby.
Otázka č. 34: Aké sú kľúčové faktory pri financovaní a navrhovaní klinických skúšok?
Odpoveď: Zdroje financovania klinických skúšok významne ovplyvňujú návrh štúdie, výber liečby a určenie koncových bodov. Komerčné financovanie sa zvyčajne zameriava na patentovateľnú liečbu s potenciálnou trhovou hodnotou, zatiaľ čo verejné alebo akademické financovanie môže sledovať širšie výskumné otázky alebo skúmať menej ziskové, ale potenciálne hodnotné terapeutické prístupy.
Návrh skúšania musí vyvážiť vedeckú prísnosť s praktickými aspektmi, ako je nábor pacientov, nákladové obmedzenia a regulačné požiadavky. Výber koncových bodov, kontrolných skupín a kritérií zaradenia môže významne ovplyvniť vedeckú platnosť výsledkov aj ich praktickú použiteľnosť pri rozhodovaní o liečbe v reálnom svete.
Otázka 35: Ako sa vyvíjajú štandardné protokoly starostlivosti v liečbe rakoviny?
Odpoveď: Protokoly štandardnej starostlivosti sa vyvíjajú v zložitom procese, ktorý zahŕňa výsledky klinických skúšok, dôkazy z reálneho sveta, konsenzus odborníkov a praktické úvahy. Tieto protokoly sa zvyčajne menia postupne, ako sa objavujú nové dôkazy, hoci občas môžu dramatické objavy viesť k rýchlym zmenám v prístupoch k liečbe.
Vývoj štandardov starostlivosti musí vyvažovať integráciu nových liečebných postupov s praktickými hľadiskami, ako sú náklady, dostupnosť a problémy pri implementácii. Tento proces sa často líši v závislosti od regiónu a systému zdravotnej starostlivosti, čo vedie k rozdielom v štandardných liečebných postupoch v rôznych krajinách a prostrediach praxe.
Otázka 36: Aký vplyv má mikroprostredie nádoru na účinnosť liečby?
Odpoveď: Nádorové mikroprostredie vytvára komplexný ekosystém, ktorý významne ovplyvňuje odpoveď na liečbu prostredníctvom faktorov, ako je tvorba krvných ciev, infiltrácia imunitných buniek a metabolické interakcie. Toto prostredie môže chrániť rakovinové bunky pred terapeutickými látkami vytváraním fyzických bariér, zmenou metabolizmu liečiv a podporou mechanizmov rezistencie.
Dynamická povaha nádorového mikroprostredia znamená, že sa môže prispôsobiť liečbe a často si vytvorí ochranné mechanizmy, ktoré časom znižujú terapeutickú účinnosť. Pochopenie týchto adaptácií viedlo k stratégiám zameraným na rakovinové bunky aj ich podporné prostredie vrátane prístupov na úpravu tvorby krvných ciev, imunitnej odpovede a metabolických interakcií.
Otázka 37: Ako sa líši miera prežitia v rôznych typoch a štádiách rakoviny?
Odpoveď: Miera prežitia vykazuje výrazné rozdiely v závislosti od typu rakoviny, štádia v čase diagnózy a molekulárnych charakteristík nádoru. Zatiaľ čo niektoré druhy rakoviny majú v súčasnosti vysokú mieru vyliečiteľnosti, ak sa zachytia včas, iné je stále náročné účinne liečiť aj v počiatočných štádiách, čo odráža zásadné rozdiely v biológii nádorov a ich reakcii na liečbu.
Miery prežitia v jednotlivých štádiách poskytujú dôležité prognostické informácie, ale musia sa interpretovať v kontexte individuálnych faktorov pacienta, ako je vek, celkový zdravotný stav a špecifické charakteristiky nádoru. Tieto ukazovatele sa naďalej vyvíjajú, pretože sú k dispozícii nové liečebné postupy a zlepšujú sa metódy včasnej detekcie.
Otázka 38: Akú úlohu zohráva zápal pri vzniku a progresii rakoviny?
Odpoveď: V čom spočíva zápal? Chronický zápal vytvára podmienky, ktoré podporujú rozvoj rakoviny prostredníctvom viacerých mechanizmov vrátane poškodenia DNA, zvýšenej proliferácie buniek a zmeneného metabolizmu tkanív. Toto zápalové prostredie môže podporovať počiatočnú premenu normálnych buniek na rakovinové bunky a naďalej podporovať rast a šírenie nádorov.
Vzťah medzi zápalom a rakovinou zahŕňa komplexné interakcie medzi imunitnými bunkami, signálnymi molekulami a metabolickými procesmi. Pochopenie týchto vzťahov viedlo k terapeutickým stratégiám zameraným na zápalové dráhy, hoci problém spočíva v rozlišovaní medzi škodlivými a prospešnými zápalovými reakciami.
Otázka 39: Ako ovplyvňuje frekvencia vedľajších účinkov výber liečby?
Odpoveď: Profily vedľajších účinkov významne ovplyvňujú výber liečby tým, že ovplyvňujú kvalitu života aj schopnosť udržať terapeutické dávkovanie. Frekvencia a závažnosť vedľajších účinkov musí byť vyvážená potenciálnymi prínosmi, pričom sa musia zohľadniť faktory, ako je vek pacienta, celkový zdravotný stav a ciele liečby.
Výber liečby často zahŕňa porovnávanie rôznych profilov vedľajších účinkov v rámci dostupných možností, pričom sa berie do úvahy krátkodobá toxicita aj potenciálne dlhodobé komplikácie. Toto hodnotenie je obzvlášť dôležité v situáciách, keď viaceré možnosti liečby ponúkajú podobnú účinnosť, ale odlišné modely vedľajších účinkov.
Otázka 40: Aký význam má testovanie biomarkerov pri diagnostike a liečbe rakoviny?
Odpoveď: Testovanie biomarkerov poskytuje kľúčové informácie o charakteristikách nádoru, ktoré môžu predpovedať odpoveď na liečbu a usmerniť výber liečby. Tieto molekulárne ukazovatele pomáhajú identifikovať pacientov, u ktorých je najväčšia pravdepodobnosť, že budú mať prospech z konkrétnej liečby, čo umožňuje personalizovanejšie terapeutické prístupy a potenciálne lepšie výsledky.
Vývoj testovania biomarkerov viedol k čoraz sofistikovanejším procesom výberu liečby, hoci stále pretrvávajú problémy pri určovaní, ktoré markery sú pre rôzne situácie najvhodnejšie. Náklady a dostupnosť testovania môžu tiež vytvárať prekážky pre optimálny výber liečby, najmä v podmienkach s obmedzenými zdrojmi.
Otázka 41: Ako sa vyvíja rezistencia na lieky v rakovinových bunkách?
Odpoveď: Rezistencia na lieky sa vyvíja prostredníctvom viacerých adaptívnych mechanizmov vrátane zvýšeného úniku liečiv, zmenených cieľov liečiv, zvýšenej opravy DNA a metabolických zmien. Rakovinové bunky môžu získať tieto mechanizmy rezistencie buď prostredníctvom genetických mutácií, alebo rýchlym prispôsobením bunkových procesov, ktoré často zahŕňajú viacero dráh súčasne.
Vývoj rezistencie často zahŕňa selekciu už existujúcich rezistentných bunkových populácií v rámci heterogénnych nádorov, po ktorej nasleduje ich expanzia pod tlakom liečby. Tento proces komplikuje schopnosť nádorových buniek zdieľať mechanizmy rezistencie prostredníctvom medzibunkovej komunikácie a uvoľňovania ochranných faktorov do mikroprostredia nádoru.
Otázka 42: Akú úlohu zohráva epigenetika pri vývoji rakoviny?
Odpoveď: Epigenetické modifikácie ovplyvňujú vývoj rakoviny tým, že menia vzorce expresie génov bez zmeny sekvencií DNA, čím ovplyvňujú bunkovú diferenciáciu, metabolizmus a kontrolu rastu. Tieto zmeny sa môžu dediť pri delení buniek a môžu byť ovplyvnené faktormi prostredia, čím vzniká spojenie medzi vonkajšími podmienkami a rizikom vzniku rakoviny.
Reverzibilná povaha epigenetických modifikácií z nich robí potenciálne terapeutické ciele, čo vedie k vývoju liečby, ktorej cieľom je obnoviť normálne vzorce expresie génov. Pochopenie epigenetických mechanizmov odhalilo, ako môžu expozície v ranom veku a faktory životného štýlu ovplyvniť riziko rakoviny prostredníctvom trvalých zmien v regulácii génov.
Otázka 43: Ako prispievajú rôzne zobrazovacie technológie k diagnostike a monitorovaniu rakoviny?
Odpoveď: Moderné zobrazovacie technológie poskytujú kľúčové informácie o lokalizácii nádoru, jeho veľkosti, metabolickej aktivite a odpovedi na liečbu prostredníctvom rôznych modalít vrátane PET, CT, MRI a molekulárneho zobrazovania. Každá technológia ponúka jedinečné výhody pri vizualizácii rôznych aspektov biológie rakoviny, čo umožňuje komplexné posúdenie stavu a progresie ochorenia.
Integrácia viacerých zobrazovacích prístupov, často v kombinácii s analýzou umelej inteligencie, umožňuje presnejšiu diagnostiku, určovanie štádia a monitorovanie liečby. Tieto technológie sa naďalej vyvíjajú a ponúkajú čoraz väčšiu presnosť pri odhaľovaní malých nádorov, hodnotení odpovede na liečbu a usmerňovaní chirurgických zákrokov.
Otázka 44: Aký význam má včasné odhalenie pre výsledky liečby rakoviny?
Odpoveď: Včasná detekcia významne zlepšuje výsledky liečby tým, že identifikuje rakovinu skôr, ako sa rozšíri alebo metastázuje, čo umožňuje cielenejšie a menej agresívne zásahy. Pri včasnom odhalení možno mnohé druhy rakoviny liečiť s kuratívnym zámerom, čo si často vyžaduje menej rozsiahly chirurgický zákrok a menej systémovej liečby.
Výhody včasného odhalenia treba vyvážiť rizikami nadmernej diagnózy a zbytočnej liečby, najmä v skríningových programoch. Táto rovnováha sa líši v závislosti od typu rakoviny a metódy skríningu, čo si vyžaduje dôkladné zváženie individuálnych rizikových faktorov aj prínosov na úrovni populácie.
Otázka 45: Ako ovplyvňujú faktory stravovania riziko vzniku rakoviny a výsledky liečby?
Odpoveď: Stravovacie faktory ovplyvňujú riziko rakoviny prostredníctvom viacerých mechanizmov vrátane vplyvu na zápal, hladiny hormónov a bunkový metabolizmus. Špecifické stravovacie návyky môžu podporovať alebo brzdiť rozvoj rakoviny prostredníctvom ich vplyvu na oxidačný stres, opravu DNA a funkciu imunitného systému.
Počas liečby rakoviny môže výber stravy ovplyvniť účinnosť liečby a zvládanie vedľajších účinkov. Metabolické požiadavky rakovinových buniek a ich reakcia na dostupnosť živín viedli k zvýšenému záujmu o diétne intervencie ako súčasť komplexných liečebných stratégií, hoci optimálne prístupy sa často líšia podľa typu rakoviny a liečebného protokolu.
Otázka 46: Akú úlohu zohráva imunitný systém v prevencii a liečbe rakoviny?
Odpoveď: Imunitný systém slúži ako kritická obrana proti vzniku rakoviny prostredníctvom nepretržitého dohľadu a eliminácie potenciálne rakovinových buniek. Táto prirodzená ochrana zahŕňa spoluprácu viacerých typov imunitných buniek, ktoré rozpoznávajú a ničia abnormálne bunky skôr, ako sa v nich vytvorí nádor, a zároveň si udržiavajú pamäť proti antigénom špecifickým pre rakovinu.
Cieľom imunoterapeutickej liečby je posilniť alebo obnoviť túto prirodzenú protinádorovú imunitu prostredníctvom rôznych prístupov vrátane inhibície kontrolných bodov, bunkovej terapie CAR-T a vakcín proti rakovine. Úspech týchto liečebných postupov do veľkej miery závisí od pochopenia komplexných interakcií medzi imunitnými a rakovinovými bunkami, ako aj mechanizmov, ktoré nádory používajú na vyhýbanie sa imunitnému rozpoznaniu.
Otázka 47: Ako sa cielené terapie líšia od tradičnej chemoterapie?
Odpoveď: Na rozdiel od tradičnej chemoterapie, ktorá ovplyvňuje všetky rýchlo sa deliace bunky, sú cielené terapie navrhnuté tak, aby zasahovali do špecifických molekulárnych dráh nevyhnutných pre rast a prežitie rakovinových buniek. Tieto liečby sa často zameriavajú na jedinečné vlastnosti rakovinových buniek, ako sú špecifické proteínové mutácie alebo nadmerne exprimované rastové faktory, čo môže priniesť vyššiu účinnosť s menším počtom vedľajších účinkov.
Špecifickosť cielenej liečby si vyžaduje podrobné molekulárne profilovanie nádorov na identifikáciu vhodných cieľov liečby, čo vedie k personalizovanejším liečebným prístupom. Rakovinové bunky však často nadobúdajú rezistenciu voči cieleným terapiám prostredníctvom alternatívnych ciest, čo si vyžaduje kombinované prístupy alebo stratégie postupnej liečby.
Otázka 48: Aký význam má personalizovaná medicína v liečbe rakoviny?
Odpoveď: Personalizovaná medicína v liečbe rakoviny zahŕňa prispôsobenie terapeutických prístupov na základe špecifických molekulárnych charakteristík jednotlivých nádorov a faktorov pacienta. Tento prístup integruje genetické profilovanie, testovanie biomarkerov a klinické charakteristiky s cieľom vybrať najvhodnejšiu liečbu pre každého pacienta, čo môže zlepšiť výsledky a zároveň minimalizovať zbytočnú liečbu.
Zavedenie personalizovanej medicíny si vyžaduje sofistikované diagnostické testy a možnosti analýzy údajov, čo vytvára príležitosti aj výzvy pre systémy zdravotnej starostlivosti. Tento prístup sa naďalej vyvíja s tým, ako sa sprístupňujú nové technológie a liečby, hoci náklady a dostupnosť zostávajú významnými faktormi.
Otázka 49: Ako mechanizmy rádioterapie ovplyvňujú rakovinové aj zdravé bunky?
Odpoveď: Rádioterapia funguje tak, že spôsobuje poškodenie DNA, ktoré vedie k smrti buniek, pričom rakovinové bunky sú vo všeobecnosti náchylnejšie vzhľadom na ich oslabené opravné mechanizmy a rýchlu rýchlosť delenia. Biologické účinky žiarenia presahujú priame poškodenie DNA a zahŕňajú zmeny v mikroprostredí nádoru a systémové imunitné reakcie.
Cieľom moderných ožarovacích techník je maximalizovať poškodenie nádorového tkaniva a zároveň šetriť zdravé bunky prostredníctvom presného cielenia a rozpisu frakcionácie. Vývoj nových metód podávania a kombinácií s inými liečebnými postupmi naďalej zlepšuje terapeutické okno rádioterapie.
Ak sa Vám tento preklad páčil a viete o niekom, koho by mohol zaujať, s kľudným svedomím ho prepošlite komukoľvek vo svojom zozname spriaznených duší…Otázka 50: Akú úlohu zohráva stres pri vývoji a progresii rakoviny?
Odpoveď: Chronický stres ovplyvňuje vývoj a progresiu rakoviny prostredníctvom viacerých biologických ciest vrátane vplyvu na imunitné funkcie, zápal a hladiny hormónov. Zmeny súvisiace so stresom môžu v tele vytvoriť podmienky, ktoré podporujú prežívanie a šírenie rakovinových buniek a zároveň potenciálne znižujú účinnosť prirodzených protirakovinových mechanizmov.
Vzťah medzi stresom a rakovinou zahŕňa priame biologické účinky aj nepriame vplyvy prostredníctvom zmien správania a dodržiavania liečby. Pochopenie týchto súvislostí viedlo k zvýšeniu pozornosti venovanej zvládaniu stresu ako súčasti komplexnej onkologickej starostlivosti, hoci meranie a modifikácia účinkov stresu zostáva náročná.
preklad: Kishitusumo Takadonomi –>https://tinyurl.com/yxxk3y9a
Radikálne uzdravenie
Pre tých, ktorí sú na tomto Substacku noví, som toho o rakovine napísal už dosť.
Liečba nevyliečiteľného ochorenia: rakoviny
Vzhľadom na prudký nárast počtu prípadov rakoviny je načase objasniť si, čo vieme.
Integratívne prístupy k rakovine: rozhovor s Pierrom Korym
Jednou z najčastejších požiadaviek, ktoré dostávam od čitateľov, je diskusia o liečbe rakoviny. To zase hovorí o širšom probléme – napriek tomu, že o holistickú liečbu rakoviny je obrovský záujem, existuje len veľmi málo zdrojov pre pacientov, ktorí tieto možnosti hľadajú.